
| A. | 树立“同呼吸、共奋斗”的行为推测,倡导节约、绿色消费方式和生活习惯 | |
| B. | 用浸泡过的高锰酸钾的硅藻土来吸收香蕉产生的乙烯,达到保鲜的目的 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型有机高分子材料 | |
| D. | 雾霾天气的形成与机动车辆猛增和尾气超标有关 |
分析 A.倡导节约、绿色消费方式和生活习惯有利于环境保护,有利于资源的可持续性发展;
B.乙烯具有催熟作用,乙烯能够被酸性的高锰酸钾氧化;
C.碳纤维是一种新型的无机非金属材料;
D.机动车尾气中含有大量粉尘颗粒,能够引起雾霾.
解答 解:A.倡导节约、绿色消费方式和生活习惯有利于环境保护,有利于资源的可持续性发展,故A正确;
B.乙烯具有催熟作用,为了延长水果的保鲜期,用高锰酸钾可以除掉乙烯,该过程中乙烯与高锰酸钾发生氧化还原反应,故B正确;
C.碳纤维是一种新型的无机非金属材料,不是高分子材料,故C错误;
D.机动车尾气中含有大量粉尘颗粒,能够引起雾霾,故D正确;
故选:C.
点评 本题考查了化学与社会生活,明确生活中常见的环境污染与治理、明确乙烯的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 3:5 | B. | 2:3 | C. | 3:2 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b-2a)bmol•L-1 | B. | $\frac{(b-2a)}{2}$bmol•L-1 | C. | (2b-a)bmol•L-1 | D. | $\frac{(2b-a)}{2}$bmol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子的电子式: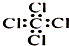 | B. | 对硝基甲苯的结构简式: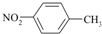 | ||
| C. | 羟基的电子式: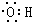 | D. | 乙醛的结构简式:CH3COH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是1:1 | |
| B. | 该浓硝酸中HN03的物质的量浓度是14.0mo1•L-1 | |
| C. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| D. | 得到3.12g沉淀时,加入NaOH溶液的体积是620mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略).
A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略). ,C的俗名为火碱或烧碱;
,C的俗名为火碱或烧碱;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com