
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
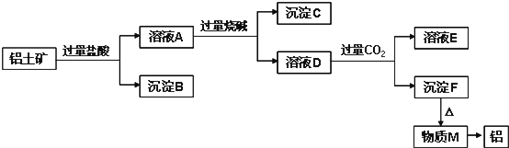
请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为____________________;
(2)由物质M制取铝的化学方程式为____________________;
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________;
(4)取一定量的沉淀C置于试管中,逐滴向试管中加入过量HI至沉淀全部溶解,所得溶液中Fe元素以_______存在,检验该离子的实验操作和现象是________________。
【答案】 Al3++4OH-=AlO2-+2H2O 2Al2O3![]() 4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe2+ 取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在。
4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe2+ 取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在。
【解析】(1)溶液A与转化为溶液D的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(2)根据流程图沉淀F为氢氧化铝,氢氧化铝受热分解生成氧化铝和水,反应为:2Al(OH)3![]() Al2O3+3H2O,M为Al2O3,电解熔融的氧化铝可以制取铝,方程式为:2Al2O3
Al2O3+3H2O,M为Al2O3,电解熔融的氧化铝可以制取铝,方程式为:2Al2O3![]() 4Al + 3O2↑,故答案为:2Al2O3
4Al + 3O2↑,故答案为:2Al2O3![]() 4Al + 3O2↑;
4Al + 3O2↑;
(3)溶液A中含有镁离子、铁离子和铝离子、氢离子,加入过量烧碱,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以溶液D中含偏铝酸根离子,通入过量CO2和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)取一定量的沉淀C中含有氢氧化镁和氢氧化铁,置于试管中,逐滴向试管中加入过量HI至沉淀全部溶解,溶解生成的铁离子能够将碘离子氧化,铁离子被还原为亚铁离子,检验亚铁离子可以取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在,故答案为:Fe2+;取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是
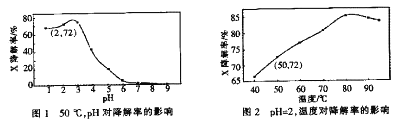
A. 50oC,PH在3~6之间,X降解率随pH增大而减小
B. pH=2,温度在40~80oC,X降解率随温度升高而增大
C. 无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80oC
D. pH=2、温度为50oC,10min内v(X)=1.44x10-4mol·L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液和胶体的叙述,一定正确的是( )。
A. 溶液是电中性的,胶体是带电的
B. 卤水点豆腐与胶体的性质无关
C. 布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
D. 一束光线分别通过溶液和胶体时,后者会出现明显的光路,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和苯都是重要的有机化工原料,下列有关说法正确的是( )
A.二者分子中均存在碳碳双键
B.二者均属于芳香烃
C.二者均可使酸性高锰酸钾溶液褪色
D.二者在一定条件下均能与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100mL含Cu2+、Al3+、NH4+、H+、Cl-的溶液,向该溶液中逐滴加入2.5mol·L-1NaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:

(1)B点的沉淀物的化学式为______________。
(2)原溶液中Cu2+的物质的量为______,原溶液中Cl-物质的量浓度为__________。
(3)原溶液的pH=__________,x-y= _________。
(4)经过滤得到D点的沉淀物,并多次用蒸馏水洗涤沉淀,判断沉淀是否洗涤干净的方法是_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为 ,已知:
,已知:![]() ,有关核黄素的下列说法中,不正确的是
,有关核黄素的下列说法中,不正确的是
A. 该化合物的分子式为C17H22N4O6
B. 酸性条件下加热水解,有CO2生成
C. 酸性条件下加热水解,所得溶液加碱后有NH3生成
D. 能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家发现某药物M能治疗血管疾病,是因为它在人体内能释放出一种“信使分子”D。已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,则M的分子式是______。D是双原子分子,相对分子质量为30,则D的分子式为_____。
(2)油脂A经下列途径可得到M:
![]()
图中②的提示:R—OH+HO—NO2![]() R—O—NO2+H2O(R代表烃基)
R—O—NO2+H2O(R代表烃基)
反应②的化学方程式为____________。
(3)C是B与乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:_________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗_____ g金属钠。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成硝酸的基础是NH3的催化氧化,某实验小组实验室中对该反应进行了探究。回答下列问题:
(1)气体制备与净化
①实验室常采用装置甲制备干燥纯净的NH3,则制取NH3的化学方程式___________________,仪器B中选取的试剂是______________(名称)。

②该小组采用KClO3 MnO2制备纯净的O2,通过查阅资料,发现该方法制备的O2中含有Cl2杂质。图乙是该小组制备纯净O2时可能用到的装置。装置连接顺序为C![]() ______ (部分仪器可重复使用),其中除去Cl反应的化学方程式为_________。
______ (部分仪器可重复使用),其中除去Cl反应的化学方程式为_________。
(2)氨的催化氧化
打开图中活塞h和活塞i,将(1)中制备的纯净NH3、O2 (O2过量) 通入到F装置中,喷灯加热,观察现象。
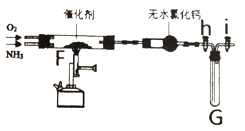
操作步骤 | 实验现象 | 解释原因 |
待铂粉为红热状态,停止加热 | 铂粉持续红热,G试管内① _____________ | ②__________ |
关闭活塞h和活塞i,取下装置 G,将该装置置于冷水中 | G中试管内③__________ | ④__________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com