
【题目】CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O![]() 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
A. 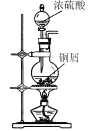 制备SO2
制备SO2
B. 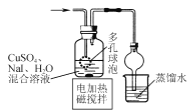 制备CuI并制备少量含SO2的溶液
制备CuI并制备少量含SO2的溶液
C. 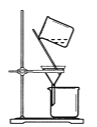 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
D. 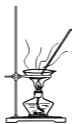 加热干燥湿的CuI固体
加热干燥湿的CuI固体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
A | 配制480mL0.1mol/LCuSO4溶液 | 称取8.0g无水硫酸铜放在烧杯中,加入480mL的蒸馏水,用玻璃棒搅拌。 |
B | 除去氯化钠固体中少量的碳酸钙 | 加水稀盐酸、然后加热蒸干。 |
C | 提取碘水中的碘 | 用量筒量取一定量的碘水,倒入分液漏斗,注入四氯化碳,振荡、静置后分液。 |
D | 除去N2气体中的少量O2 | 点燃,然后将混合气体通入澄清石灰水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )

A.反应的化学方程式为2N![]() M
M
B.t2时,正逆反应速率相等达到平衡状态
C.t1时,M的浓度是N浓度的2倍
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
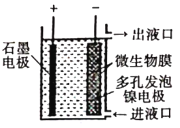
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是__,画出配合物离子[Cu(NH3)4]2+中的配位键__.
(2)根据VSEPR模型,H3O+的分子立体结构为__,BCl3的立体结构为__.
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种)
正四面体分子__,三角锥形分子__,V形分子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molNH4+含有的电子数为11NA
B.0.1L3mol/L的NH4NO3溶液中氮原子数等于0.6NA
C.常温下,92gNO2与N2O4混合气体中氧原子数为2NA
D.硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。

(1)在元素周期表中全部是金属元素的区域为_____________。
a.A b.B c.C d.D
(2)I和II元素形成的化合物的化学式为_____,一定含有____键。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置__并写出甲单质与NaOH溶液反应的离子方程式____。
②甲、乙两元素中,金属性较强的是_____(填元素名称),可以验证该结论的实验是____(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分別和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校同学设计下列实验,探究CaS脱除烟气中的SO2并回收S。实验步骤如下:
步骤1.称取一定量的CaS放入三口烧瓶中并加入甲醇作溶剂(如下图所示)。
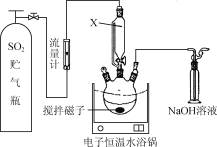
步骤2.向CaS的甲醇悬浊液中缓缓通入一定量的SO2。
步骤3.过滤,得滤液和滤渣。
步骤4.从滤液中回收甲醇(沸点为64.7 ℃),所得残渣与步骤3的滤渣合并。
步骤5.用CS2从滤渣中萃取回收单质S。
(1) 图中用仪器X代替普通分液漏斗的突出优点是________________。
(2) 三口烧瓶中生成硫和亚硫酸钙的化学方程式为________________,三口烧瓶中最后残留固体中含一定量的CaSO4,其原因是________________。
(3) 步骤4“回收甲醇”需进行的操作方法是________________。
(4) 步骤5为使滤渣中S尽可能被萃取,可采取的操作方案是________________。
(5) 请设计从上述回收的S和得到的含Na2SO3吸收液制备Na2S2O3·5H2O的实验方案:
称取稍过量硫粉放入烧杯中,__________________________________________,用滤纸吸干。
已知:① 在液体沸腾状态下,可发生反应Na2SO3+S+5H2O![]() Na2S2O3·5H2O。
Na2S2O3·5H2O。
②硫不溶于Na2SO3溶液,微溶于乙醇。
③为获得纯净产品,需要进行脱色处理。
④须使用的试剂:S、Na2SO3吸收液、乙醇、活性炭。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

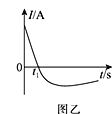
t1s前,原电池的负极是铝片,正极的电极反应式为________,溶液中的H+向______(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com