
【题目】为除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选用
A.烧碱溶液B.浓氨水C.镁粉D.铁粉
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天的游客佩戴变色眼镜来保护眼睛的镜片是陶瓷的
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A. ①②③ B. ②④ C. ③④⑤ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 2.0 g重水(2H2O)中含有的质子数为10NA
B. 50mL 18.4 molL-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
C. 分子数为NA的N2、C2H4混合气体体积约为22.4 L,质量为28 g
D. 标准状况下,22.4LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
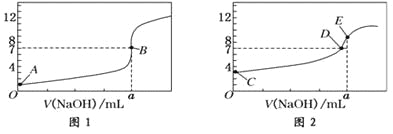
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=________kJ·mol-1。标准状况下的煤气(CO、H2)33.6 L与氧气反应生成CO2和H2O,反应过程中转移________mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO、H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为_________,则该电池的正极反应式是____________。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10 L,则该温度下的平衡常数K=________;此时在B点时容器的体积VB________10 L(填“大于”“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。

①已知100 ℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为_______。
②图中的p1________p2(填“<”“>”或“=”)。
③该反应的ΔH________0(填“<”“>”或“=”)。
(2)在压强为0.1 MPa条件下,a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0……Ⅱ。
CH3OH(g) ΔH<0……Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
A.则上表中剩余的实验条件数据:a=________,b=________。
B.根据反应Ⅱ的特点,如图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=________MPa。

(3)以甲醇作为燃料制成的燃料电池结构示意图如图所示。

关于该电池的叙述正确的是________。
A.当电池反应消耗了1 mol甲醇时,溶液中转移了12NA个e-
B.电池的负极反应为CH3OH+H2O-6e-===CO2↑+6H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/3 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
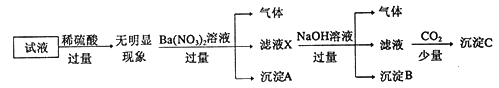
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是
A.被还原的物质是还原剂
B.氧化剂被还原,还原剂被氧化
C.失去电子,化合价降低的物质是还原剂
D.氧化剂失去电子,化合价升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com