
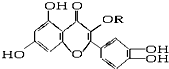
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 | |
| B. | 可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 | |
| C. | 一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
分析 由结构可知,分子中含酚-OH、碳碳双键、羰基、醚键等,结合酚、烯烃等有机物的性质来解答.
解答 解:A.酚-OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,则与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2,故A正确;
B.只有4个酚-OH与NaOH反应,则与NaOH溶液反应,1 mol该物质可与4mol NaOH反应,故B错误;
C.苯环、双键、羰基均与氢气发生加成反应,一定条件下1 mol该物质可与H2加成,耗H2最大量为8 mol,故C错误;
D.不含-COOC-、-CONH-、-X等,则不能发生水解反应,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃、苯的性质及分析与应用能力的考查,选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2NA个H2与NA个O2的质量比为1:8 | |
| B. | 0.5NA个HCl所占的体积约为11.2L | |
| C. | 71gCl2所含的Cl数目为2NA | |
| D. | 1L 0.5mol•L-1FeCl3溶液中含有1.5NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (写结构简式)可以合成二肽(如图2)
(写结构简式)可以合成二肽(如图2)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若高分子对应的单体只有一种,则此高聚物与单体一定有相同的最简式 | |
| B. | 等物质的量的乙烯与乙醇充分燃烧时消耗氧气的质量不相等 | |
| C. | 分子式为C6H12的某链状有机物,且6个碳原子一定在同一平面上,则与氢气加成后产物的名称为:2,3一二甲基丁烷 | |
| D. | 有机物 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气的大量排放--光化学污染--咳嗽和气喘者增多 | |
| B. | 生活污水任意排放--空气中CO2浓度增大--温室效应 | |
| C. | 含磷洗衣粉的大量使用--水体富营养化--水栖生物大量死亡 | |
| D. | 劣质装饰材料的大量使用--甲醛、苯等释放--致癌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com