
【题目】下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B. NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D. Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
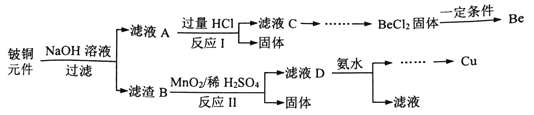
已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I、Br的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知ba=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是
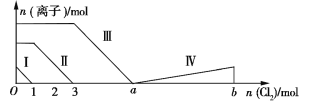
A. 线段Ⅱ表示Br的变化情况
B. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
C. 根据图象无法计算a的值
D. 线段Ⅳ表示![]() 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100mL1.00mol/L的NaCl溶液时,下列说法正确的是( )
A.选用250mL容量瓶
B.俯视容量瓶刻度线定容
C.溶解搅拌时有液体溅出,会使所配制溶液浓度偏低
D.定容后摇匀,发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHCO3的溶解度较小。在饱和的NH3和NaCl的混合溶液中通入CO2,可析出NaHCO3(固体):NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。据此,我国杰出的化学家侯德榜设计出了生产纯碱的方法:
饱和NaCl(溶液)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
这种方法被人们称为侯氏制碱法,打破了帝国主义对我国经济的一种封锁,大长了中国人的民族志气。
试回答下列问题:
(1)写出由NaHCO3固体制取Na2CO3的化学方程式:__________________。
(2)如果Na2CO3(固体)中混有NaHCO3(固体),应如何除去?_____________(写出方法);如果NaHCO3(溶液)中混有Na2CO3(溶液),应如何除去?________(写出化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH) nClm·yH2O]X,式中m等于
A. 3-n B. 6-n C. 6+n D. 3+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。

Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是 ______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Na2CO3溶液
加入试剂的顺序是_____________;
II.实验室利用精盐配制480mL 2.0mol·L1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是(_________)
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧铅蓄电池经粗加工可得到铅膏,其主要成分为PbO、PbO2、PbSO4等。以铅膏为原料回收PbSO4,流程如下:
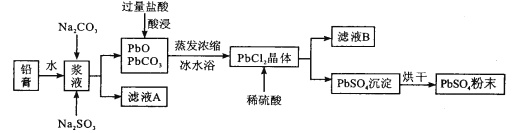
已知:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)ΔH>0
PbCl42-(aq)ΔH>0
(1)用Na2CO3作转化剂,将铅膏中的硫酸铅转化为碳酸铅,其离子方程式为_______。
(2)浆液中加入Na2SO3溶液的目的是________。
(3)从滤液A提取Na2SO4·10H2O晶体,主要步骤为______、______、过滤、洗涤、干燥;上述流程中可循环利用的物质是_________(写化学式)。
(4)采用冰水浴得PbCl2晶体的原因是________。
(5)理论上要得到a吨的PbSO4,则铅膏的质量范围为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 、△S>0
B. N2(g)+3H2(g)![]() 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
C. 水解反应NH4++H2O![]() NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
D. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com