
| n |
| V |
| V(标准)×c(标准) |
| V(待测) |
| m |
| M |
| 6g |
| 60g/mol |
| n |
| V |
| 0.1mol |
| 0.1L |
| cV |
| 20 |
| cV |
| 20 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
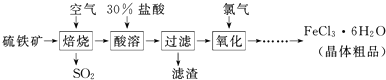
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2O(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
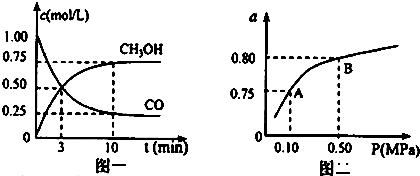
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定时,用待测溶液润洗锥形瓶 |
| B、使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小 |
| C、用酸式滴定管量取12.00 mL高锰酸钾溶液 |
| D、在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x>y | B、x=y |
| C、x<y | D、x≥y |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入水时,CH3COOH的电离程度增大 |
| B、加入少量NaOH固体,平衡向正反应方向移动 |
| C、通入少量 HCl气体,溶液中c(H+)减小 |
| D、加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com