
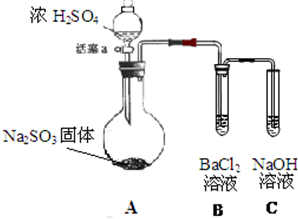
 某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):
某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):分析 (1)依据仪器的形状说出其名称;浓硫酸与亚硫酸钠固体在加热条件下反应生成硫酸钠、二氧化硫和水,依据反应中硫元素化合价变化,结合强酸制备弱酸的规律解答;
(2)亚硫酸钡沉淀易溶于盐酸,硫酸钡不溶于盐酸;二氧化硫具有还原性能够被氧气氧化生成硫酸,据此解答;
(3)硝酸根离子具有强的氧化性,在酸性环境下能够氧化二氧化硫生成硫酸根离子,硫酸根离子能与钡离子反应生成硫酸钡沉淀;亚硫酸钠为强碱弱酸盐,溶液显碱性,碱性环境下 硝酸根离子不表现强的氧化性;
(4)浓硫酸虽然具有强氧化性,但是不能氧化亚硫酸根离子,浓硝酸具有强氧化性,会将亚硫酸钠氧化为硫酸钠,得不到SO2气体,所以对该实验有影响;
(5)依据化合物中各元素化合价代数和为0判断元素化合价;分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒判断转移电子数.
解答 解:(1)依据仪器形状可知,装置A中盛有Na2SO3固体的仪器名称是圆底烧瓶,生成二氧化硫的化学方程式为:Na2SO3(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+SO2↑+H2O,反应中硫元素化合价不变,该反应是非氧化还原反应,硫酸酸性强于亚硫酸,所以依据强酸制备弱酸规律可知,浓硫酸只体现了酸性作用,
故答案为:圆底烧瓶;Na2SO3(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+SO2↑+H2O;酸;
(2)亚硫酸钡沉淀易溶于盐酸,所以不溶于酸的沉淀只能是硫酸钡,由于题目已经提示存在着氧气的干扰,所以生成硫酸钡沉淀的过程为:2SO2+O2+2H2O=2H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl,
故答案为:2SO2+O2+2H2O=2H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl;
(3)硝酸根离子具有强的氧化性,在酸性环境下能够氧化二氧化硫生成硫酸根离子,离子方程式:3SO2+2NO3-+2H2O+3Ba2+=3BaSO4↓+2NO↑+4H+
亚硫酸钠是弱碱性环境,NO3-不能体现出强氧化性,只能发生复分解反应,化学方程式为:Na2SO3+Ba(NO3)2=2NaNO3+BaSO3↓;
故答案为:3SO2+2NO3-+2H2O+3Ba2+=3BaSO4↓+2NO↑+4H+;
Na2SO3+Ba(NO3)2=2NaNO3+BaSO3↓;
(4)浓硫酸虽然具有强氧化性,但是不能氧化亚硫酸根离子,浓硝酸具有强氧化性,会将亚硫酸钠氧化为硫酸钠,得不到SO2气体,所以对该实验有影响;
故答案为:是;浓硝酸具有强氧化性,会将亚硫酸钠氧化为硫酸钠,得不到SO2气体;
(5)由于+3价Fe和-2价S不能共存,所以Cu和Fe都为+2价,Cu元素和O元素化合价都降低,均被还原.
S从-2价升高到+4价,有一半的Fe从+2价升高到+3价,所以每生成8molCu转移电子数目为6×16+1×4=100NA,所以生成4mol铜时,此反应转移的电子数目是50NA.
故答案为:+2;+2; Cu、O; 50NA.
点评 本题考查了二氧化硫的制备,明确二氧化硫的性质及制备原理是解题关键,注意浓硫酸、硝酸的强氧化性,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 红色石蕊试纸检验NH3 | B. | 品红试纸检验SO2 | ||
| C. | 碘化钾淀粉试纸检验Cl2 | D. | pH试纸检验溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,该反应中氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| , | 实验操作 | 预期现象 | 结 论 |
| 验证猜想I] | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 | 含有Fe2+ |
| 步骤②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不变为蓝色 | 不含Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置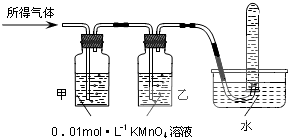 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
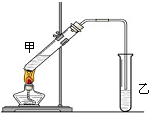 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: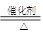 CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.
CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
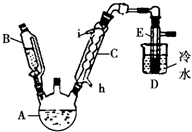 如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.
如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.| 乙醇 | 溴乙烷 | 溴 | |
| 通常情况下状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com