
| A. | 甲烷、乙炔、乙烯、丙烯 | B. | 苯、甲苯、己烷 | ||
| C. | CH3CHO、CH3COOH、CH3CH2OH | D. | C6H5OH、C6H5C2H5、C6H6 |
分析 A.乙炔、乙烯、丙烯均含不饱和键;
B.苯、甲苯、己烷均不溶于水,密度均比水小;
C.利用氢氧化铜可鉴别;
D.C6H5C2H5、C6H6均不溶于水,密度均比水小.
解答 解:A.乙炔、乙烯、丙烯均含不饱和键,则一种试剂不能鉴别,故A不选;
B.苯、甲苯、己烷均不溶于水,密度均比水小,则一种试剂不能鉴别,故B不选;
C.分别氢氧化铜混合的现象为:砖红色沉淀、蓝色溶液、无现象,现象不同可鉴别,故C选;
D.C6H5C2H5、C6H6均不溶于水,密度均比水小,则一种试剂不能鉴别,故D不选;
故选C.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质、性质差异及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | A属于酚类,可与NaHCO3溶液反应产生CO2 | |
| B. | B属于酚类,能使FeCl3溶液显紫色 | |
| C. | 1 mol C最多能与1 mol Br2发生苯环上取代反应 | |
| D. | D属于醇类,可以发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -317.3 kJ•mol-1 | B. | -379.3 kJ•mol-1 | C. | +317.3 kJ•mol-1 | D. | +379.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
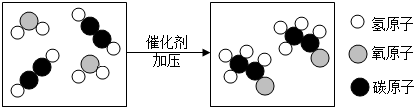
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
)中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com