
【题目】某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物;②煤和石油都是可再生能源;③![]() 和
和![]() 都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
都是电解质;④不锈钢和目前流通的硬币都是合金;⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥鸡蛋清的水溶液和雾都是胶体.上述说法正确的是( )
A.①②④B.①⑤⑥C.②③④⑤D.①③④⑥
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.22.4 L NO2中含有原子数为3 NA
B.1molNH3与1molNH![]() 所含电子数均为10NA
所含电子数均为10NA
C.14 g乙烯与丙烯的混合气体中所含碳原子数目为2NA
D.密闭容器中2 molSO2与1 mol O2在一定条件下充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),下列条件的改变对反应速率几乎无影响的是
Fe3O4(s)+4H2(g),下列条件的改变对反应速率几乎无影响的是
A. 把铁块换成铁粉 B. 将容器的体积压缩至原体积的一半
C. 压强不变,充入氮气使容器体积增大 D. 体积不变,充入氮气使容器压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是( )
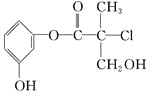
A. 该有机物能与溴水发生加成反应
B. 该有机物与浓硫酸混合加热可发生消去反应
C. 1 mol 该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D. 该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组发现有机化合物A的结构如图所示:
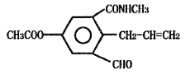
下列有关化合物A说法正确的是
A.化合物A的分子式为C14H13NO4
B.向化合物A中加入少量溴水,观察到溴水褪色,证明化合物A中含碳碳双键
C.1 mol化合物A最多可与3 mol NaOH溶液发生反应
D.化合物A可发生加成、氧化、缩聚、取代等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PHB塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为![]() ,下面有关PHB的说法不正确的是( )
,下面有关PHB的说法不正确的是( )
A.PHB通过加聚反应制得
B.PHB的单体是CH3CH2CH(OH)COOH
C.PHB在微生物作用下的降解产物可能有CO2和H2O
D.PHB是一种聚酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72— 还原为Cr3+。该反应的离子反应方程式为___________________________________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②“水浸”要获得浸出液的操作是______。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为____。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是____。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() +H2O)。
+H2O)。

①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为______。 ②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 __________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是
A.NaHS水解的离子方程式:HS-+H2O=S2-+H3O+
B.Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C.NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO42-
D.Na2S水解的离子方程式:S2-+2H2O=H2S+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com