
下列分子的结构中,原子的最外层不能都满足8电子稳定结构的是
| A.CO2 | B.PCl3 | C.CCl4 | D.HCl |
科目:高中化学 来源: 题型:阅读理解




| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

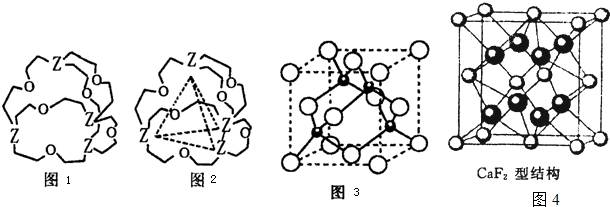
(1)根据各图表示的结构特点,写出对应分子的化学式:
A____________;B____________;C____________;D____________。
(2)用以上图示表示下列物质的结构:
①H2O ②CH4 ③CO2 ④HClO
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市綦江中学高一下学期期末模拟考试化学试卷(带解析) 题型:填空题
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物, E的阳离子与A的阴离子核外电子层结构相同。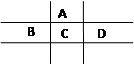
请回答下列问题:
⑴B元素在周期表中的位置为 。
⑵写出A与氢元素能形成原子物质的量之比为1∶1的化合物的电子式 ,分子中所含共价键的类型为 。
⑶比较A、C氢化物的的沸点:A C(填大于、小于或等于),
原因是 。
⑷B、C、D的原子半径由大到小的顺序为(用元素符号表示) 。
⑸若将E制作成电极与石墨用导线相连,回答下列问题:
①将两电极插入盛有稀H2SO4的烧杯中形成原电池,E电极为 极,写出该电池的总反应(用离子方程式表示) 。
②若将两电极插入盛有NaOH溶液的烧杯中,能否形成原电池?若能,请写出总反应的化学方程式 ;若不能,其理由是 。
查看答案和解析>>
科目:高中化学 来源:2015届贵州省高一第二学期期末检测化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物, E的阳离子与A的阴离子核外电子层结构相同。

请回答下列问题:
⑴C元素在周期表中的位置为 。
⑵写出A与氢元素能形成原子物质的量之比为1∶1的化合物的结构式 ,分子中所含共价键的类型为 。
⑶比较A、C氢化物的稳定性:A C(填大于、小于或等于),原因是 。
⑷B、C、D的原子半径由大到小的顺序为(用元素符号表示) 。
⑸若将E制作成电极与石墨用导线相连,回答下列问题:
将两电极插入盛有稀H2SO4的烧杯中形成原电池,E电极为 极,写出该电池的负极的电极反应是: ;电池总反应(用离子方程式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com