
| A、0.02mol |
| B、0.04mol |
| C、0.06mol |
| D、0.08mol |
| ||
| 1.6g |
| 80g/mol |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、用萃取分液的方法除去酒精中的水 |
| C、用可见光束照射以区别溶液和胶体 |
| D、根据火焰所呈现的特征焰色,只能检验金属离子的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气通过灼热的CuO粉末 |
| B、二氧化碳通过Na2O2粉末 |
| C、将锌粒投入Cu(NO3)2溶液 |
| D、碳酸氢钠固体加热至没有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
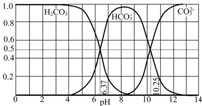 (1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于两支试管中 | ′ |
| 步骤2: | 若有 |
| 步骤3: | 若有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )| A、常温常压下,L是一种液态有机物 |
| B、E的二溴代物只有一种结构 |
| C、G具有强氧化性和漂白性 |
| D、上述反应的类型是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
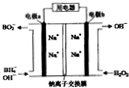 以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )
以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )| A、该电池工作时Na+由a极区移向b极区 |
| B、正极材料采用MnO2,MnO2既做电极材料又有催化作用 |
| C、该电池的负极反应为:BH4-+8OH--8e-→BO2-+6H2O |
| D、电路中通过6.02×1022个电子时,理论上消耗H2O2 0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com