
| A. | 23g钠与足量氧气充分反应,转移的电子个数为NA | |
| B. | 将1molFeCl3水解制成胶体,所得胶体的微粒数为NA | |
| C. | 1mol Na2O2与水完全反应时转移电子数为2NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
分析 A.钠为+1价金属,23g钠为1mol,完全反应失去1mol电子;
B.氢氧化铁胶体为氢氧化铁的聚集体,无法计算胶粒数目;
C.1mol过氧化钠完全反应生成0.5mol氧气,过氧化钠中氧元素的化合价为-1价,据此判断转移电子数;
D.NA个一氧化碳分子的物质的量为1mol,质量为28g;0.5 mol甲烷的质量为8g.
解答 解:A.23g钠的物质的量为:$\frac{23g}{23g/mol}$=1mol,1mol钠完全反应失去1mol电子,转移的电子个数为NA,故A正确;
B.将1molFeCl3水解制成胶体,由于氢氧化铁胶粒为氢氧化铁聚集体,则含有胶粒的物质的量小于1mol,所得胶体的微粒数小于NA,故B错误;
C.1mol过氧化钠与水完全反应生成0.5mol氧气,转移了1mol电子,转移电子数为NA,故C错误;
D.NA个一氧化碳分子的物质的量为1mol,质量为:28g/mol×1mol=28g,0.5 mol甲烷的质量为8g,二者的质量比为:28g:8g=7:2,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确过氧化钠中氧元素的化合价为-1价;B为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 凡金属跟非金属元素化合时都能形成离子键 | |
| B. | 离子化合物熔融状态下一定导电 | |
| C. | 离子化合物中的阳离子只能是金属离子,酸根离子中不能含有金属元素 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
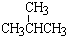 和
和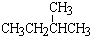 ; ②
; ②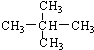 和
和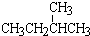 ; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 | ⑤⑥ | ①③ | ④⑧ | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

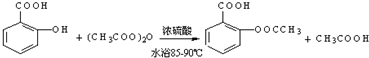 ;反应类型取代反应;
;反应类型取代反应;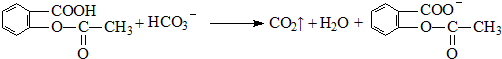 、
、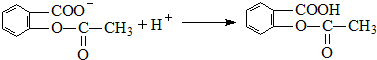 ;
;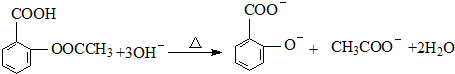 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
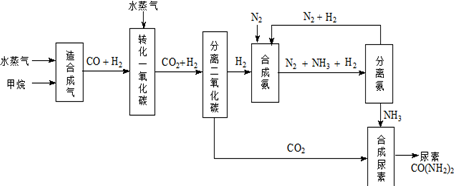
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0015 g•cm-3 | B. | 0.0012 g•cm-3 | C. | 0.0024 g•cm-3 | D. | 0.002 g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色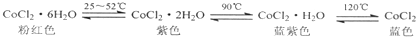 | |
| B. | 已知铬酸根(黄色)和重铬酸根(橙色)离子间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,若加水稀释,则溶液中所有离子浓度均减少 | |
| C. | 若反应2A(g)+B(s)?C(g)+3D(g)只有高温下才能自发进行,则该反应的△H>0 | |
| D. | 增大反应物的浓度,可使单位体积内活化分子数目增多,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | NaHCO3和过量的澄清石灰水反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| D. | NH4HSO3溶液与足量NaOH溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com