
 ;
;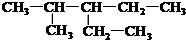 ;
;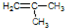 .
. 分析 ①乙炔中含有碳碳三键,能发生与溴发生加成反应,通入过量的溴的四氯化碳溶液生成1,1,2,2-四溴乙烷;
②2-溴丙烷与氢氧化钠水溶液共热,发生水解反应生成2-丙醇;
(2)该烷烃最长碳链为5个,从左到右依次编号,2号碳原子上有一个甲基,3号碳上有1个乙基;
(3)这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,计算2.8g有机物的物质的量,结合生成水和二氧化碳的质量可计算有机物的分子式,并以此确定有机物同分异构体的结构简式.
解答 解:(1)①乙炔中含有碳碳三键,与过量的溴能1:2加成生成1,1,2,2-四溴乙烷,化学方程式为:CH≡CH+2Br2→CHBr2-CHBr2;
故答案为:CH≡CH+2Br2→CHBr2-CHBr2;
②2-溴丙烷与氢氧化钠水溶液共热,发生水解反应生成2-丙醇,反应为 ,
,
故答案为: ;
;
(2)根据烷烃的命名方法,2-甲基-3-乙基戊烷,最长碳链为5个,从左到右依次编号,2号碳原子上有一个甲基,3号碳上有1个乙基,该有机物的结构简式为: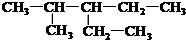 ,
,
故答案为: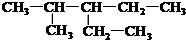 ;
;
(3)①这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56;
n(A)==0.05mol,
n(C)=n(CO2)==0.2mol,
n(H)=2n(H2O)=2×=0.4mol,
故有机物分子中含有C原子数目为=4,含有H原子数目为=8,
因为12×4+1×8=56=M(A),所以没有O元素;
∴分子式为C4H8,
故答案为:C4H8;
②已知分子式为C4H8,且为链状结构,则分子中有一个C=C,则结构简式为:CH2=CHCH2CH3,CH3CH=CH2CH3 ,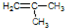 ,
,
故答案为:CH2=CHCH2CH3,CH3CH=CH2CH3 ,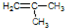 .
.
点评 本题考查有机物的结构、命名、推断,侧重于学生的分析、计算能力的考查,题目难度中等,(3)注意根据有机物生成的二氧化碳和水的质量结合相对分子质量判断有机物的分子式,注意有机物的结构特点.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol/L CH3COONa溶液显碱性 | |
| B. | 0.1 mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100 ml 1 mol/L 的CH3COOH溶液需要100 ml 1 mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
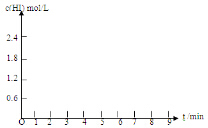
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用氨水将SO2转化为(NH4)2SO3、(NH4)2SO4 |
| 方法Ⅱ | 用生石灰吸收SO2,再转化为CaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
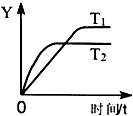
| A. | 温度T2<T1 | |
| B. | 反应达到平衡后放出99kJ的热量 | |
| C. | Y可能是SO2的转化率或SO3的浓度 | |
| D. | 反应达到平衡后容器内气体的密度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
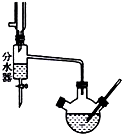 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ③④⑥ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com