
| A. | 4.9g | B. | 8.0g | C. | 9.8g | D. | 19.6g |
分析 n(CuSO4•5H2O)=$\frac{25g}{250g/mol}$=0.1mol,根据Cu原子守恒得n(CuSO4•5H2O)=n(CuSO4),Cu和浓硫酸反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,根据硫酸铜和被还原硫酸的关系式计算.
解答 解:n(CuSO4•5H2O)=$\frac{25g}{250g/mol}$=0.1mol,根据Cu原子守恒得n(CuSO4•5H2O)=n(CuSO4),Cu和浓硫酸反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,根据方程式知,该反应中有一半的硫酸做氧化剂,所以0.1mol硫酸铜生成时有0.1mol硫酸被还原,其质量=0.1mol×98g/mol=9.8g,故选C.
点评 本题以浓硫酸为载体考查氧化还原反应的计算,侧重考查分析计算能力,利用原子守恒及方程式进行计算,知道硫酸的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2溶液中 c(K+)=2c(SO42-) | |
| B. | 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大 | |
| C. | 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-)=c(Br-) | |
| D. | 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸Ka=1.75×10-5 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
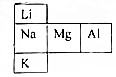 试分析它们的原子结构(电子层数、最外层电子)请指出:
试分析它们的原子结构(电子层数、最外层电子)请指出:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
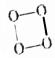 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )| A. | O4与O3、O2互为同素异形体 | |
| B. | O4与H2反应生成冰 | |
| C. | O4中各原子最外电子层均达到8电子结构 | |
| D. | O4的化学性质一定比O2稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3 | B. | NaOH和Na2SO3 | C. | Na2SO3 | D. | Na2SO3和NaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子种类 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4g乙烯和丙烯混合气体中含有C-H键的数目为0.2NA | |
| B. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 标准状况下,11.2LCO2与足量Na2O2反应,转移的电子数为NA | |
| D. | 若将1mol氧化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多 | HX酸性比HY弱 |
| B | 先向2mL0.15mol•L-1 Na2S溶液中滴几滴0.15mol•L-1 ZnSO4溶液,再加入几滴0.1mol•L-1 CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 向紫色石蕊试液中持续长时间通入氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com