
(1)分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不可能为________。
A.醇 B.醛
C.羧酸 D.酚
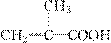 |
(3)与 具有相同官能团的同分异构体的结构简式为
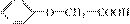 _______________。
_______________。
(4)苯氧乙酸( )有多种酯类的同分异构体。其中能与FeCl3溶
液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_________________(写出任意2种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)________种。
解析 (1)能与金属钠反应放出H2的有机物有醇、酚、羧酸、葡萄糖等。分子式为C4H10O并能与Na反应放出H2,符合饱和一元醇的通式和性质特点,应为一元醇C4H9OH,因—C4H9有4种,则C4H9OH也有4种。
(2)C7H10O2若为酚类物质应含有苯环,则7个C最多需要8个H,故不可能为酚。
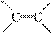 |
(3)该化合物中有 和—COOH两种官能团,由于官能团不变,只将官能团的位
置移动即可得其同分异构体:CH2===CHCH2COOH、CH3CH===CHCOOH。
(4)根据题意,符合条件的同分异构体满足:①属于酯类即含有酯基,②含酚羟基,③苯环上有两种一硝基取代物。
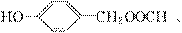
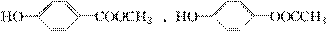
(5)分子式为C5H10的烯烃共有
CH2===CHCH2CH2CH3、CH3CH===CHCH2CH3、
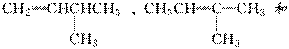
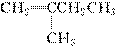 共5种。
共5种。
答案 (1)4 (2)D
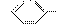 (3)CH2===CHCH2COOH、CH3CH===CHCOOH
(3)CH2===CHCH2COOH、CH3CH===CHCOOH
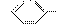 (4
(4 )HO CH2OOCH、
)HO CH2OOCH、
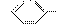 HO COOCH3、
HO COOCH3、
HO OOCCH3(任写2种)
(5)5


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
________________________________________________________________________。
(2)同浓度的CH3COO-、HCO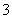 、CO
、CO 、ClO-结合H+的能力由强到弱的顺序为________________________________________________________________________。
、ClO-结合H+的能力由强到弱的顺序为________________________________________________________________________。
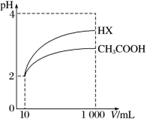
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了钠与氯气反应的装置,如下图所示。将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,直到钠熔融成圆球时,停止加热,通入氯气,即可见钠燃烧起来,产生大量白烟。下面的有关叙述错误的是( )
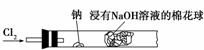
A.钠燃烧产生苍白色火焰
B.浸有NaOH溶液的棉花球是用于吸收过量的氯气,以避免污染空气
C.反应产生的大量白烟是氯化钠晶体
D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可以判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。
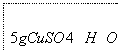 —→
—→ —→
—→
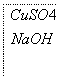 —→
—→ —→
—→
 —→
—→ —→
—→
(1)调整天平零点时,若指针偏向左边,应将左边的螺丝________(填“向左”或“向右”)旋动。
(2)溶解样品时要用到玻璃棒,其作用是_ ________________________________ ___________________________________________________________________。
(3)反应生成沉淀的离子方程式为______________________________________ ______________________________________________________________。
(4)加热蒸发过程中要用到玻璃棒,其作用是_ __________________________________ _________________________________________________________________。
(5)过滤中要用到玻璃棒,其作用是_________________________ _________________________。
(6)洗涤沉淀的目的是
__________________________________________________;
洗涤沉淀的方法是
__________________________________________________;
为了检验沉淀是否洗涤干净,应在最后一次的洗涤液中加入________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是____________,属于化合反应的是____________,属于分解反应的是________________________,属于置换反应的是______________,属于复分解反应的是______________。
①Cu2S+O2 2Cu+SO2
2Cu+SO2
②3O2 2O3
2O3
③Fe2O3+3CO===2Fe+3CO2
④2Na+2H2O===2NaOH+H2↑
⑤CaCO3 CaO+CO2↑
CaO+CO2↑
⑥2H2O2===2H2O+O2↑
⑦SO3+H2O===H2SO4
⑧2Fe+3Cl2 2FeCl3
2FeCl3
⑨H2SO4+2NaOH===Na2SO4+2H2O
⑩NaH+H2O===NaOH+H2↑
⑪IBr+H2O===HIO+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+===3Fe2+,下列离子氧化性比较顺序正确的是( )
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+
C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为
aFe2++bBr-+cCl2—→dFe3++eBr2+fCl-
下列选项中的数字与离子方程式的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
A.2 4 3 2 2 6 B.0 2 1 0 1 2
C.2 0 1 2 0 2 D.2 2 2 2 1 4
查看答案和解析>>
科目:高中化学 来源: 题型:
配平下列方程式
(1)[2011·福建理综,23(6)]在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O===Ce(OH)4↓+________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com