
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
分析 (1)根据物质的分类标准和物质所属的类别来回答;
(2)发生离子反应:H++OH-=H2O,是强酸强碱发生反应生成溶于水的盐;
(3)Al2(SO4)3属于盐是强电解质,水溶液中完全电离;
(4)少量的④通入⑥的溶液中反应,是二氧化碳通入氢氧化钡溶液中反应生成碳酸钡沉淀和水;
(5)依据化学方程式中元素化合价变化分析,元素化合价降低的物质做氧化剂,元素化合价升高的物质做还原剂,依据电子守恒计算氧化剂和还原剂物质的量之比,电子转移总数,硝酸和硝酸铝都是强电解质完全电离,几次写出反应的离子方程式
解答 解:(1)铝是只有金属铝元素组成的金属单质,③Na2O和④CO2中含有两种元素其中一种元素是氧元素,属于氧化物,⑧氨水和⑨稀硝酸属于混合物,⑦红褐色的氢氧化铁液体属于胶体分散系,③⑤⑥⑩在水溶液或者熔融状态下能导电,属于电解质,
故答案为:
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 | ② | ③④ | ⑧⑨ | ⑦ | ③⑤⑥⑩ |
点评 本题考查了物质分类的依据和分析判断,化学方程式、离子方程式书写方法,物质组成和性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
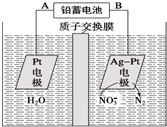
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的总反应方程式为:2H2O+4NO3- $\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| C. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 23g Na在空气中完全燃烧,转移的电子数为1 mol | |
| B. | 78gNa2O2含有的离子数为3NA | |
| C. | 0.1 mol Fe与足量水蒸气反应生成H2的分子数为0.1NA | |
| D. | 5.4 g铝与足量NaOH溶液反应,产生6.72L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
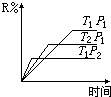 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )| A. | 正反应吸热,S是气体 | B. | 正反应吸热,S是固体 | ||
| C. | 正反应放热,S是气体 | D. | 正反应放热,S是固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaHS溶液中滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大 | |
| B. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| C. | 0.1 mol•L-1 Na2SO3溶液加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| D. | 常温下pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | 常温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 浓度均为0.1mol/L的①NH4Cl ②NH3•H2O ③NH4HSO4 ④NH4HCO3四种溶液,c(NH4+)由大到小的顺序为:③>①>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量ClO-的溶液中:K+、Na+、I ?、SO32? | |
| B. | 使pH试纸变深蓝色的溶液中:NH4+、Na+、SO42?、Cl- | |
| C. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、K+ | |
| D. | c(Al3+)=0.1 mol•L-1的溶液中:Na+、NH4+、AlO2?、SO42? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com