
| A. | 为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连 | |
| B. | 在盛水的铁器中,空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆或油脂 | |
| D. | 纯银器表面在空气中因化学腐蚀渐渐变暗 |
分析 A、电解池的阳极金属容易被腐蚀,阴极金属被保护;
B、根据金属电化学腐蚀的原理来回答;
C、根据金属腐蚀与防护的方法来回答;
D、银和硫化氢反应生成黑色的硫化银.
解答 解:A、为保护地下钢管不受腐蚀,可使它与直流电源负极相连,因为电解池的阳极金属容易被腐蚀,阴极金属被保护,故A错误;
B、盛水的铁器,在空气与水交界处形成原电池,能加速金属铁的腐蚀速率,所以盛水的铁器,在空气与水交界处更容易锈蚀最利害,故B正确;
C、金属腐蚀的原因之一是和空气接触,在金属表面涂油漆、油脂可以将金属和空气隔绝,故C正确;
D、银和空气中硫化氢发生化学反应而生成黑色的硫化银导致逐渐变暗,发生化学腐蚀,故D正确;
故选A.
点评 本题涉及金属的腐蚀和防护知识,注意知识的归纳和梳理是解题的关键,难度不大.


科目:高中化学 来源: 题型:解答题

 、G
、G .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
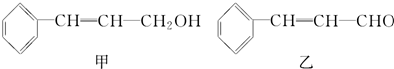
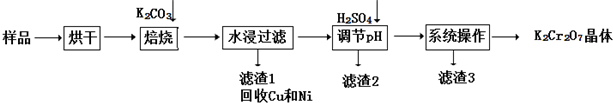
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
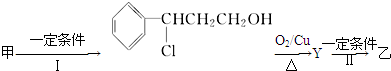
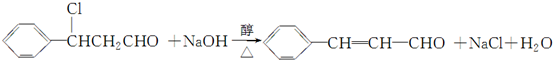 (注明反应条件).
(注明反应条件).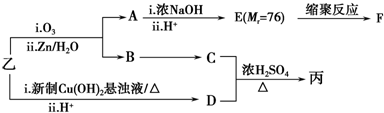
 .
.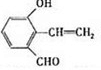 .
.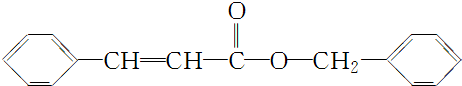 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,纯水的pH都等于7 | |
| B. | 在任何条件下,纯水都呈中性 | |
| C. | 在95℃时,纯水的 pH小于7,显酸性 | |
| D. | 在95℃时,纯水中的[H+]小于10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
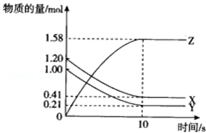 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com