
| A. | 氢氟酸电离的热化学方程式为:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1 | |
| B. | 当V=20时,溶液中:c(OH-)=c(H+)+c(HF) | |
| C. | 当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol/L | |
| D. | 当V=20时,溶液中水的电离程度最大(忽略溶液温度的变化) |
分析 A.利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,可根据质子守恒判断;
C.当V=20时,恰好反应生成NaF,溶液呈碱性,结合电荷守恒判断;
D.V=20mL恰好反应生成NaF,F-水解促进了水的电离.
解答 解:A.利用盖斯定律将①-②可得:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,故A正确;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,根据质子守恒可得:c(OH-)=c(HF)+c(H+),故B正确;
C.当V=20时,恰好反应生成NaF,应F-水解,则c(F-)<c(Na+)=0.05mol•L-1,故C错误;
D.当V=20mL恰好反应生成NaF,F-水解促进了水的电离,溶液中水的电离程度最大,故D正确;
故选C.
点评 本题考查酸碱混合的定性判断及计算,题目难度中等,明确盖斯定律的含义及应用方法为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据质子守恒判断离子浓度大小.


科目:高中化学 来源: 题型:选择题
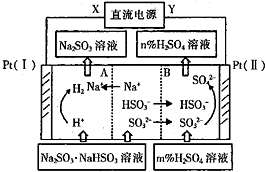
| A. | Pt(Ⅱ)为阳极 | B. | 阳极区[H+]增大 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液:K+、Na+、CH3COO-、ClO- | |
| B. | 0.1mol•L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol/LFeCl3溶液中:Al3+、NH4+、SCN-、SO42- | |
| D. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
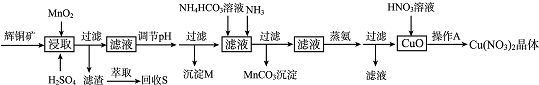
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
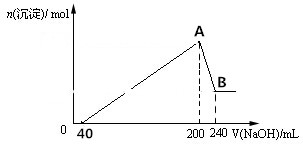
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com