
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K(300℃)>K(350℃),该反应是____热反应。
(2)如图中表示NO2浓度变化曲线的是__(填序号),用O2表示从0~2 s内该反应的平均速率v=___。

(3)能说明该反应已经达到平衡状态的是__(填字母序号)。
a.c(NO2)=2c(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___(填字母序号)。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效的催化剂
【答案】放热 b 1.5×10-3mol/(ls) bc c
【解析】
(1)K(300![]() )>K(350
)>K(350![]() ),说明升温,平衡逆向移动,说明该反应是放热反应。
),说明升温,平衡逆向移动,说明该反应是放热反应。
(2)结合表中数据分析,一氧化碳的曲线为C,则d为氧气,结合方程式分析,b为二氧化氮。0~2 s内一氧化氮的浓度变化量为![]() =0.006mol/L,用O2表示从该反应的平均速率v(O2)=
=0.006mol/L,用O2表示从该反应的平均速率v(O2)=![]() v(NO)=
v(NO)=![]() =1.5×10-3mol/(Ls);
=1.5×10-3mol/(Ls);
(3)a.c(NO2)=2c(O2)不能说明反应到平衡,故错误;
b.容器内压强保持不变说明反应到平衡,故正确;
c.v逆(NO)=2v正(O2),说明正逆反应速率相等,反应到平衡,故正确;
d.容器内的密度始终保持不变,不能说明到平衡,故错误;
故选bc;
(4)a.及时分离出NO2气体,正反应速率不能增大,故错误;
b.适当升高温度,速率增大,平衡逆向移动,故错误;
c.增大O2的浓度,速率增大,平衡正向移动,故正确;
d.选择高效的催化剂,速率增大,但平衡不移动,故错误;
故选C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 能发生的反应类型:加成反应、取代反应、消去反应、水解反应
能发生的反应类型:加成反应、取代反应、消去反应、水解反应
B.已知![]() (X)
(X)![]()
![]() (Y),X与Y互为同分异构体,可用FeCl3溶液鉴别
(Y),X与Y互为同分异构体,可用FeCl3溶液鉴别
C.3—甲基—3—乙基戊烷的一氯代物有6种
D.相同条件下乙酸乙酯在水中的溶解度比其在乙醇中的溶解度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述正确的是( )
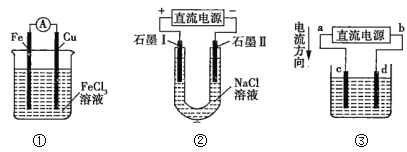
A.装置①是原电池,总反应是Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为Fe3++e-=Fe2+
C.装置②通电,两个石墨电极上都有气体产生
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
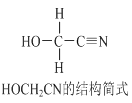
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
P(s)+5/4O2(g)=1/4P4O10(s) △H=-738.5kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)紫杉醇![]() 是一种抗癌药,化合物D是紫杉醇的侧链,D的合成路线如下
是一种抗癌药,化合物D是紫杉醇的侧链,D的合成路线如下![]() 图示中结构
图示中结构![]() 为苯基
为苯基![]() :
:
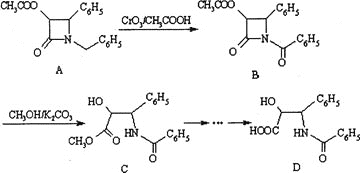
![]() 下列说法不正确的是________。
下列说法不正确的是________。
A.有机物A的分子式是![]()
B.有机物A和B结构中具有相同的官能团
C.有机物D能发生的有机反应类型有酯化、水解、加成、消去和缩聚反应
D.上述四种有机物在酸性条件下均能发生水解反应,且都能得到同一种水解产物
![]() 的合成应用了2010年诺贝尔化学奖的获奖成果
的合成应用了2010年诺贝尔化学奖的获奖成果![]() 交叉偶联反应,反应式如下
交叉偶联反应,反应式如下![]() 已配平
已配平![]() :
:![]()
![]()
![]()
X分子中含碳氮双键![]() ,其结构简式为________。
,其结构简式为________。
![]() 已知酯和酰胺在过量醇中能发生醇解反应:
已知酯和酰胺在过量醇中能发生醇解反应:
CH3COOC2H5+CH3OH![]() CH3COOCH3+C2H5OH
CH3COOCH3+C2H5OH
![]() +CH3OH
+CH3OH![]()
![]() +CH3COOCH3
+CH3COOCH3
写出B转化为C的化学方程式是________。
![]() 若最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F。写出同时符合下列条件的E的所有同分异构体的结构简式________。
若最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F。写出同时符合下列条件的E的所有同分异构体的结构简式________。
①结构中含有![]()
②遇氯化铁溶液发生显色反应
③1H-NMR谱显示分子中有四种不同化学环境的氢原子
![]() 已知:
已知:
①RCHO![]()
![]()
②R’COOH![]() R’COCl
R’COCl
采用甲醛和乙醛为原料制备![]() ,请设计合成路线_____________。
,请设计合成路线_____________。![]() 无机试剂任选
无机试剂任选![]() 。合成路线流程图示例如下:
。合成路线流程图示例如下:
CH3CH2OH![]() H2C=CH2
H2C=CH2![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、C1-)生产CuCl的流程:
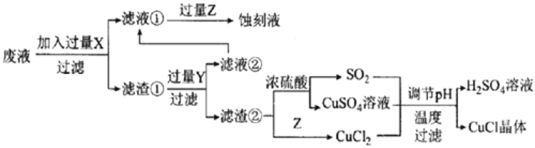
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为____________________________________________。
(2)滤液①需要加过量Z,检验Z过量的方法是______________________。
(3)写出生成CuCl的离子方程式:_________________________________。
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置图中的___________(填选项字母),过滤后,洗涤CuCl的试剂宜选用___________(填“无水乙醇”或“稀硫酸”)

(5)CuCl加入饱和NaCl溶液中会部分溶解生成CuCl2-,在一定温度下建立两个平衡:
I. CuCl (s) ![]() Cu +(aq)+Cl- (aq) Ksp=1.4×10-6
Cu +(aq)+Cl- (aq) Ksp=1.4×10-6
II. CuCl(s)+Cl- (aq)![]() CuCl2-(aq) K=0.35。
CuCl2-(aq) K=0.35。
分析c(Cu+)、c(CuCl2-)和Ksp、K的数学关系,在图中画出c(Cu+)、c(CuCl2-)的关系曲线(要求至少标出一个坐标点) ______。

(6)氯化亚铜的定量
①称取样品0.25g于250mL锥形瓶中,加入10mL过量的FeCl3溶液,不断摇动:
②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用0.1000mol·L-1硫酸铈标准溶液滴定至绿色为终点;
④重复三次,消耗硫酸铈溶液的平均体积为24.30mL。
上述相应化学反应为CuCl+ FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+,则样品中CuCl的纯度为___________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com