
| 化学键 | H-H | H-O | O=O |
| 键能kj/mol | 436 | x | 496 |
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
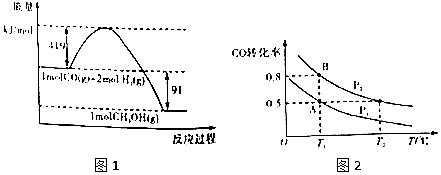
分析 (1)由图象判断,活化能为活化分子具有的能量;
(2)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物.
由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,
又已知:②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
根据盖斯定律,③×2+②-①可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(3)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol,
H2O(l)═H2O(g)△H=+44kJ/mol,
二者相加可得:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,进而计算x的值;
(4)A、B反应温度相等,则平衡常数相等,利用平衡常数计算;
(5)合成甲醇的反应为放热反应,甲为恒温恒容,乙为绝热恒容,乙温度降低,平衡常数增大,丙恒温恒压,体积应增大,以此解答.
解答 解:(1)由图形可知甲醇的活化能为(419+91)kJ/mol=510kJ/mol,故答案为:510;
(2)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物.
由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,
又已知:②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
根据盖斯定律,③×2+②-①可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1;
(3)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol,
H2O(l)═H2O(g)△H=+44kJ/mol
二者相加可得:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-240 kJ/mol,
反应热=反应物总键能-生成物总键能,则436kJ/mol+$\frac{1}{2}$×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,
故答案为:462;
(4)A、B两容器温度相同,即化学平衡常数相等,A点时转化率为50%,则K=$\frac{0.25}{0.25×{1}^{2}}$=1,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 30 0
转化(mol):8 16 8
平衡(mol):2 1 4 8
设体积为VL,则有K=$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{14}{V})^{2}}$=1,V=7L,
故答案为:7;
(5)A.丙为甲醇的分解是气体体积增大的反应,所以丙恒温恒压,体积变大,甲恒温恒容,体积不变,所以,V甲<V丙,故A错误;
B.合成甲醇是放热反应,其逆反应甲醇分解就是吸热的,乙绝热容器,丙恒温,所以乙反应后比丙温度低,向吸热方向进行的程度小,平衡时乙中甲醇浓度比丙高,CO和氢气浓度比丙低,K乙>K丙,故B正确;
C.条件相同时,甲与乙是等效平衡.甲与乙容器体积相同,乙分解甲醇吸热导致乙比甲温度低,平衡向合成甲醇方向移动,平衡时甲醇浓度乙大于甲,即c乙>c甲,故C正确;
D.甲与丙起始温度和起始体积相同,恒温条件下反应,丙在恒压条件下分解甲醇生成氢气和CO,平衡时体积比反应前大,即平衡时丙体积大于甲,则压强甲大于丙,所以υ甲>υ丙,故D错误.
故答案为:BC.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析能力和计算能力的考查,主要考查学生对表格数据的分析利用能力和利用勒夏特列原理分析平衡移动的思维,题目有一定难度.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>①>② | |
| B. | 将①、④等体积混合,则混合液的PH为7 | |
| C. | 四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ | |
| D. | 将②加入③至恰好完全反应,则消耗体积为③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O | B. | Na2O+H2O═2NaOH | ||
| C. | Na2CO3+H2SO4═Na2SO4+CO2↑+H2O | D. | KClO3+6HCl (浓)═KCl+3H2O+3Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤,2次 | B. | 过滤,2次 | C. | 分液,3次 | D. | 过滤,3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 实验室制大量CO2 | 向石灰石中加入稀硫酸 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 配制0.1mol/L CuSO4溶液 | 把2.5g胆矾晶体溶于水配成100mL溶液 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com