
【题目】在中和滴定操作过程中,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空::
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 。
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 。
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果 。
(4)滴定前平视,滴定终点俯视滴定管刻度 ,使滴定结果 。
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,使滴定结果 。
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。
(8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
【答案】(1)偏高 (2)偏高 (3)偏高 (4)偏低 (5)偏低 (6)偏低 (7)偏高 (8)无影响
【解析】中和滴定误差分析的依据是c待=![]() ,,若向待测溶液(置于锥形瓶)中滴加标准溶液(置于滴定管),则由V标来分析实验误差。
,,若向待测溶液(置于锥形瓶)中滴加标准溶液(置于滴定管),则由V标来分析实验误差。
(1)滴定管装液前未用标准溶液润洗,,会使标准溶液被稀释,,导致所耗V标偏大,,使测定的c待偏高。
(2)锥形瓶装液前用待测溶液润洗,,会使锥形瓶内待测的溶质增加,,导致所耗V标偏大,,使测定的c待偏高。
(3)气泡的体积计入了标准溶液,,使结果偏高。
(4)滴定终点俯视读数,,V标偏低,因而c待偏低。
(5)终点判断提前(应保持半分钟不褪色,),结果偏低。
(6)NaOH中含有Na2O,则标准溶液的浓度已经偏高(62 g Na2O相当于80 g NaOH),因而所需滴入的标准溶液的体积偏小,测得结果偏低。
(7)把标准溶液视为Na2CO3溶液,由于53 g Na2CO3相当于40 g NaOH,所以中和相同量的盐酸所需Na2CO3溶液的体积比NaOH溶液的体积大,使V标偏高,结果偏高。
(8)食盐水对结果无影响。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种物质间存在着如下图所示的变化关系,其中A、B为单质,相对分子质量A大于B;E在通常状况下为有颜色,有刺激性气味的气体;H为一种氯化物,与碱石灰共热可制取C;G中含A元素35%. 完成下列问题: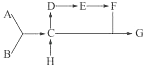
(1)用化学式表示各物质 .
(2)写出C→D的化学方程式,并标出电子转移方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列符合化学史实的是 ( )
A. 法国科学家拉瓦锡发现了元索周期律 B. 俄国科学家门捷列夫建立了氧化学说
C. 英国科学家道尔顿提出了原子学说 D. 英国科学家波义耳提出了原子学说
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的叙述中,不正确的是
A.钾钠合金呈液态,可做快中子反应堆的导热剂
B.硅酸钠俗称“水玻璃”,是制造水泥的原料
C.硅是太阳能电池的常用材料
D.氧化镁的熔点高达2800℃,是优质的耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为10 mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示可推出HCl和NaOH的物质的量浓度( )
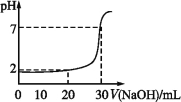
选 项 | A | B | C | D |
HCl物质的量浓度/(mol·L-1) | 0.12 | 0.04 | 0.03 | 0.09 |
NaOH物质的量浓度/(mol·L-1) | 0.04 | 0.12 | 0.09 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
2A(g)+B(g)2C(g)△H<0.达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图.下列对t1时刻改变条件的推测中正确的是( )
A.保持压强不变,升高反应温度
B.保持温度不变,增大容器体积
C.保持温度和容器体积不变,充入1 mol C(g)
D.保持温度和压强不变,充入1 mol C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )

A.相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ
B.根据滴定曲线可得,Ka(HX)=10-3 mol·L-1
C.滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+)
D.滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于Ag2S(s)![]() 2Ag+(aq)+S2-(aq),其Ksp的表达式为________。
2Ag+(aq)+S2-(aq),其Ksp的表达式为________。
(2)下列说法不正确的是______________(填序号)。
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
③对于Al(OH)3(s) ![]() Al(OH)3(aq)
Al(OH)3(aq) ![]() Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO![]() 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2?
___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com