
”¾ĢāÄæ”湤ŅµÉĻæÉÓĆČķĆĢæó(Ö÷ŅŖ³É·ÖŹĒMnO2)ŗĶ»ĘĢśæó(Ö÷ŅŖ³É·ÖŹĒFeS2)ĪŖÖ÷ŅŖŌĮĻÖʱøøߊŌÄÜ“ÅŠŌ²ÄĮĻĢ¼ĖįĆĢ(MnCO3)”£Ę乤ŅÕĮ÷³ĢČēĻĀ£ŗ£Ø £©

ŅŃÖŖ£ŗ¾»»Æ¹¤ŠņµÄÄæµÄŹĒ³żČ„ČÜŅŗÖŠµÄCa2+”¢Cu2+µČŌÓÖŹ£ØCaF2ÄŃČÜ£©”£
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ŃŠÄ„æóŹÆ”¢ŹŹµ±ÉżøßĪĀ¶Č¾łæÉĢįøßČܽž¹¤ŠņÖŠŌĮĻµÄ½ž³öĀŹ
B. ³żĢś¹¤ŠņÖŠ£¬ŌŚ¼ÓČėŹÆ»Ņµ÷½ŚČÜŅŗµÄpHĒ°£¬¼ÓČėŹŹĮæµÄČķĆĢæ󣬷¢ÉśµÄ·“Ó¦ĪŖMnO2£«2Fe2£«£«4H£«===2Fe3£«£«Mn2£«£«2H2O
C. ø±²śĘ·AµÄ»ÆѧŹ½(NH4)2S
D. “Ó³ĮĆĢ¹¤ŠņÖŠµĆµ½“æ¾»MnCO3µÄ²Ł×÷·½·ØŹĒ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ
”¾“š°ø”æC
”¾½āĪö”æÓÉĮ÷³ĢæÉÖŖČķĆĢæó(Ö÷ŅŖ³É·ÖMnO2)ŗĶ»ĘĢśæó¼ÓČėĮņĖįĖį½ž¹żĀĖµĆµ½½ž³öŅŗµ÷½ŚČÜŅŗpH£¬FeS2ŗĶĻ”ĮņĖį·“Ӧɜ³ÉFe2+£¬Č»ŗó¹żĀĖµĆµ½ĀĖŌüŹĒMnO2£¬ĻņĀĖŅŗÖŠ¼ÓČėČķĆĢæó·¢ÉśµÄĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗ2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42£¬¹żĀĖ£¬ĀĖŅŗÖŠÖ÷ŅŖŗ¬ÓŠCu2+”¢Ca2+µČŌÓÖŹ£¬¼ÓČėĮņ»Æļ§ŗĶ·ś»Æļ§£¬Éś³ÉCuS”¢CaF³Įµķ³żČ„£¬ŌŚĀĖŅŗÖŠ¼ÓČėĢ¼ĖįĒāļ§ŗĶ°±Ė®³ĮĆĢ£¬Éś³ÉMnCO3³Įµķ£¬¹żĀĖµĆµ½µÄĀĖŌüÖŠÖ÷ŅŖŗ¬ÓŠMnCO3£¬ĶعżĻ“µÓ”¢ŗęøɵƵ½MnCO3¾§Ģ唣A. Ģįøß½žČ”ĀŹµÄ“ėŹ©æÉŅŌŹĒ½Į°č”¢ŹŹµ±ÉżøßĪĀ¶Č”¢ŃŠÄ„æóŹÆ”¢ŹŹµ±Ōö“óĖįµÄÅØ¶ČµČ£¬¹ŹAÕżČ·£»B. Ö÷ŅŖ³É·ÖŹĒFeS2µÄ»ĘĢśæóŌŚĖį½ž¹ż³ĢÖŠ²śÉśŃĒĢśĄė×Ó£¬Ņņ“ĖĮ÷³ĢµŚ¶ž²½³żĢś»·½ŚµÄĢśÓ¦øĆ×Ŗ»ÆĢśĄė×Ó²ÅÄÜøüŗĆ³żČ„£¬ĖłŅŌŠčŅŖ¼ÓČėŃõ»Æ¼ĮČķĆĢæóŹ¹²ŠÓąµÄFe2+×Ŗ»ÆĪŖFe3+£¬Ąė×Ó·½³ĢŹ½ĪŖMnO2+2Fe2++4H+=2Fe3++Mn2++2H2O£¬ŌŁ¼ÓČėŹÆ»Ņµ÷½ŚpHÖµŹ¹Fe3+ĶźČ«³Įµķ£¬¹ŹBÕżČ·£»C.µĆµ½µÄĀĖŅŗÖŠ»¹ÓŠ“óĮæµÄļ§øłĄė×ÓŗĶĮņĖįøłĄė×Óƻӊ·“Ó¦£¬Ņņ“ĖæÉŅŌÖʵÄø±²śĘ·ĪŖ£ŗ(NH4)2SO4£¬¹ŹC“ķĪó£»D. “Ó³ĮĆĢ¹¤ŠņÖŠµĆµ½“æ¾»MnCO3£¬Ö»Šč½«³ĮµķĪö³öµÄMnCO3¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ¼“æÉ£¬¹ŹDÕżČ·£»¹ŹŃ”C”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬ÄÜĖµĆ÷NH3”¤H2OĪŖČõµē½āÖŹµÄŹµŃéŹĀŹµŹĒ
A. ļ§ŃĪŹÜČȶ¼Ņ×·Ö½ā
B. 0.1 mol”¤L£1NH4ClČÜŅŗµÄpH<7
C. °±Ė®ČÜŅŗÖŠÖ»ÓŠÉŁĮæµÄOH£
D. 0.1 mol”¤L£1µÄ°±Ė®ÄÜŹ¹ĪŽÉ«·ÓĢŖŹŌŅŗ±äŗģÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ30mL 1mol/L NaClČÜŅŗŗĶ40mL 0.5mol/L CaCl2ČÜŅŗ»ģŗĻŗ󣬻ģŗĻŅŗÖŠCl£ÅضČĪŖ£ŗ
A. 0.5mol/L B. 0.6mol/L C. 1.00mol/L D. 2mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æCO2ŌŚŗ£ŃóÖŠµÄ×ŖŅĘŗĶ¹éĖŽ£¬ŹĒµ±½ńŗ£ŃóæĘѧъ¾æµÄĒ°ŃŲĮģÓņ”£
£Ø1£©ČÜÓŚŗ£Ė®µÄ CO2Ö÷ŅŖŅŌ4ÖÖĪŽ»śĢ¼ŠĪŹ½“ęŌŚ£¬ĘäÖŠ HCO3£Õ¼95%£¬Š“³öCO2ČÜÓŚĖ®²śÉśHCO3£µÄ·½³ĢŹ½£ŗ___________”£
£Ø2£©ŌŚŗ£ŃóŃ»·ÖŠ£¬ĶعżČēĶ¼ĖłŹ¾µÄĶ¾¾¶¹ĢĢ¼£¬ Š“³öøĘ»Æ×÷ÓƵĥė×Ó·½³ĢŹ½__________”£

£Ø3£©ŗ£Ė®ÖŠČܽāĪŽ»śĢ¼Õ¼ŗ£Ė®×ÜĢ¼µÄ 95%ŅŌÉĻ£¬Ęä×¼Č·²āĮæŹĒŃŠ¾æŗ£ŃóĢ¼Ń»·µÄ»ł“”£¬²āĮæČܽāĪŽ»śĢ¼£¬æɲÉÓĆČēĻĀ·½·Ø£ŗ ¢ŁĘųĢį”¢ĪüŹÕCO2”£ÓĆN2“ÓĖį»ÆŗóµÄŗ£Ė®ÖŠ“µ³ö CO2 ²¢ÓĆ¼īŅŗĪüŹÕ£Ø×°ÖĆČēĶ¼£©£¬½«ŠéĻßæņÖŠµÄ×°ÖĆ²¹³äĶźÕū²¢±ź³öĖłÓĆŹŌ¼Į_________
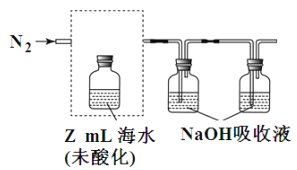
¢ŚµĪ¶Ø”£½«ĪüŹÕŅŗĪüŹÕµÄĪŽ»śĢ¼×Ŗ»ÆĪŖNaHCO3£¬ŌŁÓĆx mol/LŃĪĖįµĪ¶Ø£¬ĻūŗÄy mLŃĪĖį£¬Ōņŗ£Ė®ÖŠČܽāĪŽ»śĢ¼µÄÅضČ=________mol/L”£
£Ø4£©ĄūÓĆĻĀĶ¼ĖłŹ¾×°ÖĆ“Óŗ£Ė®ÖŠĢįČ” CO2£¬ÓŠĄūÓŚ¼õÉŁ»·¾³ĪĀŹŅĘųĢåŗ¬Į攣

¢Ł ½įŗĻ·½³ĢŹ½¼ņŹöĢįČ” CO2µÄŌĄķ£ŗ_____________”£
¢ŚÓĆøĆ×°ÖĆ²śÉśµÄĪļÖŹ“¦Ąķ bŹŅÅųöµÄŗ£Ė®£¬ŗĻøńŗóÅÅ»Ų“óŗ£”£“¦ĄķÖĮŗĻøńµÄ¾ßĢå·½·ØŹĒ__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾ŹĒ²æ·Ö¶ĢÖÜĘŚŌŖĖŲ»ÆŗĻ¼ŪÓėŌ×ÓŠņŹżµÄ¹ŲĻµĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £© 
A.Ō×Ó°ė¾¶£ŗZ£¾Y£¾X
B.ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗR£¾W
C.WX3ŗĶĖ®·“Ó¦ŠĪ³ÉµÄ»ÆŗĻĪļŹĒĄė×Ó»ÆŗĻĪļ
D.YŗĶZĮ½Õß×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ²»ÄÜĻą»„·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŌŖĖŲÖŠ£¬×īøßÕż»ÆŗĻ¼ŪŹżÖµ×ī“óµÄŹĒ
A. Na B. Cl C. F D. C
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲµŖµÄŠšŹö£¬“ķĪóµÄŹĒ£Ø £©
A. µŖĘų³£ÓĆ×÷±£»¤ĘųB. µŖĘųŌŚ³£ĪĀĻĀ»ÆѧŠŌÖŹ·Ē³£»īĘĆ
C. µŖŌŖĖŲÓŠ¶ąÖÖ»ÆŗĻ¼ŪD. µŖŌŖĖŲŹĒ¹¹³Éµ°°×ÖŹ²»æÉȱɣµÄ³É·Ö
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ£Ń§ÉśÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹµŃ飬ŅŌĢ½¾æ±½Óėäå·¢Éś·“Ó¦µÄŌĄķ²¢·ÖĄėĢį“æ·“Ó¦µÄ²śĪļ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©×°ÖĆ(¢ņ)ÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ 2Fe+3Br2 ØT2FeBr3”¢________ ”£
£Ø2£©ŹµŃéæŖŹ¼Ź±£¬¹Ų±Õ K2”¢æŖĘō K1ŗĶ·ÖŅŗĀ©¶·»īČū£¬µĪ¼Ó±½ŗĶŅŗäåµÄ»ģŗĻŅŗ£¬ ¢óÖŠŠ”ŹŌ¹ÜÄŚ±½µÄ×÷ÓĆŹĒ___________”£
£Ø3£©ÄÜĖµĆ÷±½ÓėŅŗäå·¢ÉśĮĖČ”“ś·“Ó¦µÄĻÖĻóŹĒ___________”£
£Ø4£©·“Ó¦½įŹųŗó£¬ŅŖČĆ×°ÖĆIÖŠµÄĖ®µ¹ĪüČė×°ÖĆ¢ņÖŠ£¬ÕāŃł²Ł×÷µÄÄæµÄŹĒ___________”£¼ņŹöÕāŅ»²Ł×÷µÄ·½·Ø£ŗ___________ ”£
£Ø5£©ĖÄøöŹµŃé×°ÖĆÖŠÄÜĘšµ½·Ąµ¹Īü×÷ÓƵÄ×°ÖĆÓŠ___________”£
£Ø6£©½«×°ÖĆ(¢ņ)·“Ó¦ŗóµÄŅŗĢåŅĄ“Ī½ųŠŠĻĀĮŠŹµŃé²Ł×÷¾ĶæɵƵ½½Ļ“æ¾»µÄäå±½”£
¢ŁÓĆÕōĮóĖ®Ļ“µÓ£¬Õńµ“£¬·ÖŅŗ£» ¢ŚÓĆ5%µÄNaOHČÜŅŗĻ“µÓ£¬Õńµ“£¬·ÖŅŗ£»
¢ŪÓĆÕōĮóĖ®Ļ“µÓ£¬Õńµ“£¬·ÖŅŗ£» ¢Ü¼ÓČėĪŽĖ®CaCl2·ŪÄ©øÉŌļ£»¢Ż________£ØĢī²Ł×÷Ćū³Ę£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜŌ“ŹĒ¹śĆń¾¼Ć·¢Õ¹µÄÖŲŅŖ»ł“”£¬ĪŅ¹śÄæĒ°Ź¹ÓƵÄÄÜŌ“Ö÷ŅŖŹĒ»ÆŹÆČ¼ĮĻ£®
£Ø1£©ŌŚ25”ę”¢101kPaŹ±£¬16gCH4ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®Ź±·Å³öµÄČČĮæŹĒ890.31kJ£¬ŌņCH4Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ_____________£¬
£Ø2£©ŅŃÖŖ£ŗC£Øs£©+O2£Øg£©ØTCO2£Øg£©£»”÷H=©437.3 kJmol©1
H2£Øg£©+O2£Øg£©ØTH2O£Øg£©£»”÷H=©285.8 kJmol©1
CO£Øg£©+O2£Øg£©ØTCO2£Øg£©£»”÷H=©283.0 kJmol©1
ŌņĆŗĘų»Æ·“Ó¦C£Øs£©+H2O£Øg£©ØTCO£Øg£©+H2£Øg£© µÄģŹ±ä”÷H=__________kJmol©1£»
£Ø3£©ČēĶ¼ĖłŹ¾×é³É±ÕŗĻ»ŲĀ·£¬ĘäÖŠ£¬¼××°ÖĆÖŠCH4ĪŖøŗ¼«£¬O2ŗĶCO2µÄ»ģŗĻĘųĢåĪŖÕż¼«£¬Ļ”ĶĮ½šŹō²ÄĮĻĪŖµē¼«£¬ŅŌČŪČŚĢ¼ĖįŃĪĪŖµē½āÖŹ£»ŅŅ×°ÖĆÖŠa”¢bĪŖŹÆÄ«£¬b¼«ÉĻÓŠŗģÉ«ĪļÖŹĪö³ö£¬CuSO4ČÜŅŗµÄĢå»żĪŖ200mL£®

¢Ł×°ÖĆÖŠĘųĢåAĪŖ___________£ØĢī”°CH4”±»ņ”°O2ŗĶCO2”±£©£¬d¼«ÉĻµÄµē¼«·“Ó¦Ź½ĪŖ___________£»
¢ŚŅŅ×°ÖĆÖŠa¼«ÉĻµÄµē¼«·“Ó¦Ź½ĪŖ_________£®ČōŌŚa¼«²śÉś112mL£Ø±ź×¼×“æö£©ĘųĢ壬Ōņ¼××°ÖĆÖŠĻūŗÄCH4______mL£Ø±ź×¼×“æö£©£¬ŅŅ×°ÖĆÖŠĖłµĆČÜŅŗµÄpH=_________£®£ØŗöĀŌµē½āĒ°ŗóČÜŅŗĢåĒļ±ä»Æ£©
¢ŪČē¹ūŅŅÖŠµē¼«²»±ä£¬½«ČÜŅŗ»»³É±„ŗĶNa2SO3ČÜŅŗ£¬µ±Ņõ¼«ÉĻÓŠa molĘųĢåÉś³ÉŹ±£¬Ķ¬Ź±ÓŠw g Na2SO410H2O¾§ĢåĪö³ö£¬ČōĪĀ¶Č²»±ä£¬Ź£ÓąČÜŅŗÖŠČÜÖŹµÄÖŹĮæ·ÖŹżÓ¦ĪŖ______________£ØÓĆŗ¬w”¢aµÄ±ķ“ļŹ½±ķŹ¾£¬²»±Ų»Æ¼ņ£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com