
【题目】按要求填空
(1)NH4Cl溶液呈酸性,用离子方程式表示其原因___________________________________;
(2)25℃时1g甲烷完全燃烧生成二氧化碳气体和液态水,放出56千焦的热量,写出该反应的热化学方程式:_____________________________ ;
(3)铁在空气中发生吸氧腐蚀时的正极反应方程式:_________________________________
(4)硫酸铜溶液通电时发生的化学反应方程式:_______________________________
【答案】NH4++H2O![]() NH3·H2O+H+ CH4(g)+2O2(g)=CO2(g)+H2O(l) △H=-896kJ·mol-1 O2+4e-+2H2O=4OH- 2CuSO4+2H2O= 2Cu+O2↑+2H2SO4
NH3·H2O+H+ CH4(g)+2O2(g)=CO2(g)+H2O(l) △H=-896kJ·mol-1 O2+4e-+2H2O=4OH- 2CuSO4+2H2O= 2Cu+O2↑+2H2SO4
【解析】
(1)氯化铵溶液中存在铵根离子的水解使溶液呈酸性,故答案为:NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(2)1molCH4的质量为16g,则1mol甲烷完全燃烧生成二氧化碳气体和液态水放出的热量为56kJ×16=896kJ,故答案为:CH4(g)+2O2(g)=CO2(g)+H2O(l) △H=-896kJ·mol-1;
(3)铁在空气发生吸氧腐蚀时,正极为氧气,正极发生得电子的还原反应,故答案为:O2+4e-+2H2O=4OH-;
(4)硫酸铜溶液通电时阳极发生氧化反应,Cu2+的氧化性强于氢离子,所以先在阳极放电,得电子生成铜单质,阴极发生还原反应,水电离出的OH-先于硫酸根放电,失电子生成氧气,同时水的电离平衡右移生成更多的氢离子,故答案为:2CuSO4+2H2O= 2Cu+O2↑+2H2SO4。


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:

(1)A点水的离子积为1×1014mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______.
(3)100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,两个常见的固氮反应的平衡常数的对数值(lgK)与温度的关系如图所示:①N2+3H22NH3 ②N2+O22NO;根据图中的数据判断下列说法正确的是( )

A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.在1000℃时,反应①和反应②体系中N2的浓度一定相等
D.在标准状况下,利用反应①固氮和利用反应②固氮反应程度相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,弱酸H2A溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ[δ(X)=![]() ]随溶液pH变化的关系如图所示,下列说法错误的是
]随溶液pH变化的关系如图所示,下列说法错误的是
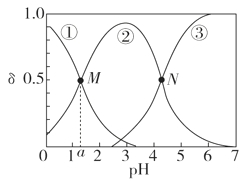
A.pH>4的溶液中,δ(A2-)= ,
,
B.M点对应的溶液中水的电离程度小于N点
C.若图中a为1.2,则lg [Ka1(H2A)]=-1.2
D.曲线②代表的粒子是HA-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据以下知识解答
![]() +R2-CHO →
+R2-CHO →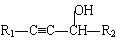 (R代表烃基,下同。)
(R代表烃基,下同。)
![]() +H2
+H2![]()
![]()
1,4―丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制备,请写出相应物质的结构简式
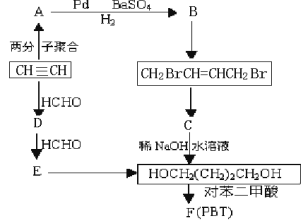
(1)请写出A和D的结构简式:________________________、_____________________。
(2)写出生成CH2BrCH=CHCH2Br的化学反应方程式:______写出生成F (PBT)的化学反应方程式:___。
(3)关于对苯二甲酸的结构,在同一直线上的原子最多有________个。
(4)某学生研究发现由乙炔可制得乙二醇,请你设计出合理的反应流程图。________________
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是
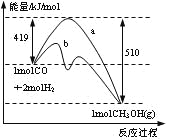
A. 该反应是吸热反应
B. 使用催化剂后反应热减小
C. 热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )

A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_________________。
(2)脱碳。
方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①下列条件可以判定该反应到达平衡状态的是_________(填字母)。
A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变
C.容器内压强不变 D.反应不再释放热量
方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:

②图中p1、p2、p3的大小关系是_________________,图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是____________。
③900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为______(保留一位小数),该反应的平衡常数K=_________。
方法三:用NaOH溶液吸收CO2。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=_______。(已知:室温下,H2CO3的K1=4×10-7,K2=5×10-11。lg2=0.3)
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成(NH4)2SO4。(NH4)2SO4水溶液呈酸性的原因是_______________(用离子方程式表示);室温时,向(NH4)2SO4溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)____c(NH3·H2O)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。某研究小组设计制备SnSO4与SnCl4路线如下。完成下列填空:
(一)制备SnSO4
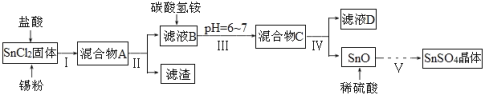
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
(1)SnCl2用盐酸进行酸溶的原因是_____________________。
(2)步骤Ⅱ中用到的玻璃仪器除烧杯外还有____________;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为______________。
(3)步骤Ⅴ依次操作:蒸发浓缩、_________、_________、洗涤、低温干燥,即可得到产物。
(二)制备SnCl4
实验室用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。实验装置如图所示:

(4)仪器B的名称______________。
(5)图中尾气处理装置不够完善,改进的方法是:________________(可以画图,也可以用文字表述,需注明仪器、试剂及连接位置等)。
(6)若反应中用去锡粉11.9 g,反应后在锥形瓶中收集到23.8 g SnCl4,则SnCl4的产率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com