
| A. | $\frac{m}{V}$mol•L-1 | B. | $\frac{m}{24V}$mol•L-1 | C. | $\frac{m}{12V}$mol•L-1 | D. | $\frac{m}{48V}$mol•L-1 |
分析 根据n=$\frac{m}{M}$计算出镁离子的物质的量,再根据氯化镁的化学式计算出氯离子的物质的量,最后根据c=$\frac{n}{V}$计算出氯离子的物质的量浓度.
解答 解:mg镁离子的物质的量为:$\frac{mg}{24g/mol}$=$\frac{m}{24}$mol,
根据化学式MgCl2可知,VL该氯化镁溶液中含有氯离子的物质的量为:$\frac{m}{24}$mol×2=$\frac{m}{12}$mol,
该溶液中氯离子的物质的量浓度为:$\frac{\frac{m}{12}mol}{VL}$=$\frac{m}{12V}$mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为 | ||
| C. | HCl的电子式为  | D. | H2O中含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
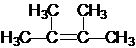 ;
; .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的水解方程式:HCO3-+H2O=CO32-+H3O+ | |
| B. | 在稀溶液中,酸跟碱反应生成1mol水时放出57.3KJ的热量,则稀盐酸与澄清石灰水发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| C. | 向NaHSO4溶液中加入过量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 用Na2CO3溶液吸收少量SO2的离子方程式:CO32-+SO2═CO2+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NO(NO2)--通入足量水中,再用向上排空气法收集气体 | |
| B. | NaHCO3溶液(Na2CO3)--通入过量CO2 | |
| C. | Cl2(HCl)--用排饱和NaCl溶液的方法收集气体 | |
| D. | CuO(C)--直接在空气中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com