
下列解释事实的离子方程式不正确的是
A.Na放入水中,产生气体:2Na + 2H2O = 2Na+ + 2OH- + H2↑
B.FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3+ + 2I-= 2Fe2+ + I2
C.铁溶于稀硝酸,溶液变黄:3Fe + 8H+ + 2NO3-= 3Fe2+ + 2NO↑+ 4H2O
D.Al片置于NaOH溶液中,产生气体:2Al + 2OH-+ 2H2O = 2AlO2- + 3H2↑
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
工业废气H2S经资源利用后可回收能量并得到单质硫。反应原理如图所示。下列说法不正确的是
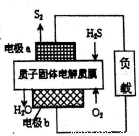
A. 电极a为电池的负极
B. 电极b上发生的电极反应为O2+4H++4e-=2H2O
C. 若电路中通过2mol电子,则电池内部释放632kJ热量
D. 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:推断题
通过以下途径可以合成具有导电性的高分子材料F:

已知:
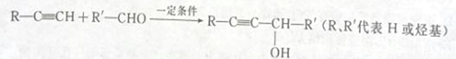
(1)物质C所含官能团的名称为____________,试剂X的结构简式是___________。
(2)条件Y是________________
(3)请写出反应②的化学方程式:__________________
(4)C与H2以1:2反应所得产物的系统命名是________________
(5)反应⑥的化学反应类型为________,反应⑤的化学方程式_____________。
(6)反应①常用饱和食盐水代替H2O,其目的是_________________
(7)写出符合下列条件在B的所有同分异构体_______________。
①能与银氨溶液反应 ②核磁共振氢谱有3个吸收峰
(8)参照上述合成信息,以丙炔、甲醛和乙酸为原料(无机试剂任选)设计路线合成乙酸—
 _________________。
_________________。
合成路线示例如下:CH2=CH2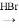 CH3CH2Br
CH3CH2Br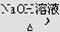 CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:选择题
将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况),然后然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g,则(m1-m2)为(单位:g)
A. 5.76 B. 3.84 C. 1.92 D. 无法计算
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组物质相互混合反应,即有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量Na2O2投入明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液 ④少量SO2通入BaCl2溶液
A. ①④ B. ①② C. ②③ D. ①③
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:简答题
利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:
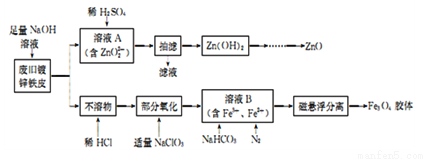
(1)用NaOH溶液处理废旧锌铁皮发生反应的化学方程式为____________。
(2)①若溶液A中滴加稀H2SO4过量,会溶解产生的Zn(OH)2,可改用的方法是____________。
②由Zn(OH)2灼烧制ZnO前需进行洗涤,检验沉淀洗涤是否干净的方法是______________。
(3)流程中加人NaC1O3发生反应的离子方程式为______________。
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是____________。
②溶液B中主要发生的离子反应方程式为________________。
③确定溶液B中含有Fe2+的实验方法是_____________。
查看答案和解析>>
科目:高中化学 来源:天津市红桥区2017届高三一模化学试卷 题型:实验题
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
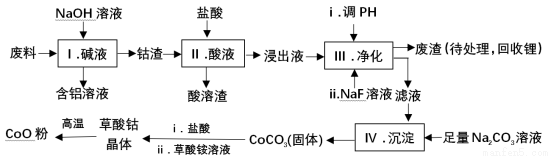
已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4.82 |
890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:选择题
电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是含Cr2O72-工业废水的电化学处理示意图。下列说法正确的是(己知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
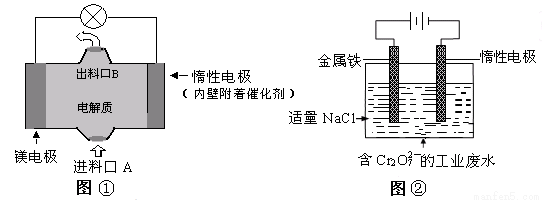
A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②中阳极上的电极反应式为:Fe-3e-=Fe3+
C. 图①中发生的还原反应是:ClO-+H2O+2e-=Cl-+2OH-
D. 若图①中7.2g镁溶解产生的电量用以图②废水处理,理论可产生32.1g氢氧化铁沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com