
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生。
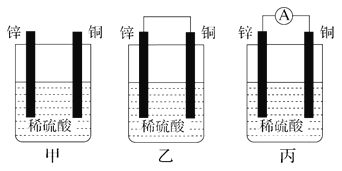
(2)用导线将电流表的两端与溶液中的锌片和铜片相连(如图丙装置所示),观察到电流表的指针发生了偏转,说明导线中有电流通过。锌片上的电极反应:______________;铜片上的电极反应:____________________________。
(3)乙、丙装置是将________能转化为________能的装置。
Ⅱ.断开1molH﹣H键,1molN﹣H键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:
(1)1molN2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ
(2)1molH2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ(不考虑可逆反应)
【答案】 没有 有 Zn-2e-===Zn2+ 2H++2e-===H2↑ 化学 电 放出 92 放出 30.7
【解析】Ⅰ. (1)铜和稀硫酸不反应, 铜片上没有气泡产生;铜与锌连接形成原电池时,锌为负极,铜为正极,正极发生还原反应生成氢气,可观察到铜片上有气泡产生;正确答案:没有;有。
(2)形成铜-锌原电池时,负极发生氧化反应,锌被氧化生成锌离子,电极方程式为. Zn-2e-===Zn2+ ,正极发生还原反应,生成氢气,电极方程式为2H++2e-===H2↑ ;正确答案: Zn-2e-===Zn2+ ;2H++2e-===H2↑。
(3)锌、铜、稀硫酸构成原电池,电流表指针发生偏转,有电流产生,因此乙、丙装置是将化学能转化为电能的装置;正确答案:化学;电。
Ⅱ.(1)反应热=化学键断裂吸收的总能量-化学键形成放出的总能量, 所以1molN2生成NH3的反应热![]() ,所以该反应为放热反应;放出92 kJ热量;正确答案:92; 放出。
,所以该反应为放热反应;放出92 kJ热量;正确答案:92; 放出。
(2)1molH2生成NH3的的反应热![]() ;正确答案:30.7。
;正确答案:30.7。
点睛; 化学反应中,化学键断裂吸收能量,形成新化学键放出能量;反应热H=反应物断键吸收的总能量-生成物成键放出的总能量。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A. 1mol乙酸、乙醇和甲酸甲酯的混合物中含有的碳原子数为2NA
B. 46gNa与一定量O2完全反应生成Na2O和Na2O2时转移的电子数为3NA
C. 0.5L1mol·L-1的NaHS溶液中含有的HS-、S2-的总数为0.5NA
D. 2molNO和1molO2充分反应后,体系中含有的NO2分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

(1)写出甲中正极的电极反应式___________________。
(2)乙中负极材料为___________________,乙中总反应的离子方程式:___________________。
(3)甲与乙同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出___________________活动性更强,而乙会判断出___________________活动性更强(填写元素符号)。
(4)由此实验得出的下列结论中,正确的有___________________。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
A. Cu+HNO3(浓)→ Cu(NO3)2 B. Cu+HNO3(稀)→ Cu(NO3)2
C. Cu![]() CuO
CuO![]() Cu(NO3)2 D. Cu
Cu(NO3)2 D. Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,并加热使之充分反应,直至Ba(OH)2溶液过量。加入Ba(OH)2溶液的体积与产生沉淀的质量和放出NH3的体积(标准状况下)的关系如下图,曲线a代表沉淀的质量变化,曲线b代表NH3的体积变化(假设NH3全部放出)。
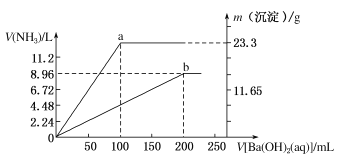
(1)混合溶液中NH![]() 的物质的量为________mol。
的物质的量为________mol。
(2)混合溶液中NO![]() 的物质的量为________mol。
的物质的量为________mol。
(3)当加入Ba(OH)2溶液的体积在100~200mL范围内,发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的是
A.Na+、Fe3+、SO42-、SCN-B.K+ 、OH-、AlO2-、Cl-
C.H+ 、Na+、Fe2+、MnO4-D.Na+、H+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
B. 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性
C. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
D. 植物秸杆的主要成分是纤维素,纤维素在催化剂作用下经水解可得葡萄糖,葡萄糖在酒化酶的作用下能转化为酒精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com