
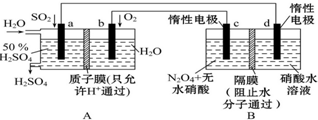
 膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:
膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:分析 (1)A装置能自发的进行氧化还原反应且没有外接电源;
(2)与电源的正极相连的电极为阳极,N2O4在阳极失电子生成N2O5;
(3)A装置中,通入二氧化硫的电极失电子发生氧化反应,为负极;
(4)根据电极方程式中物质与电子的关系计算.
解答 解:(1)A装置能自发的进行氧化还原反应且没有外接电源,所以是原电池,
故答案为:原电池;
(2)与电源的正极相连的电极为阳极,c极与正极相连为阳极,N2O4在阳极失电子生成N2O5,电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+;
故答案为:c极;N2O4+2HNO3-2e-═2N2O5+2H+;
(3)A装置中,a电极上二氧化硫失电子和水反应生成硫酸,该电极为负极,电极反应式为SO2-2e+2H2O=SO42-+4H+,
故答案为:SO2-2e+2H2O=SO42-+4H+;
(4)若A装置中通入SO2的体积为22.4L (标准状况)时,即消耗1mol二氧化硫,则转移电子为2mol,由N2O4+2HNO3-2e-═2N2O5+2H+可知,生成2molN2O5;
故答案为:2.
点评 本题考查了原电池和电解池原理,根据是否自发进行判断原电池和电解池,再结合各个电极上发生的电极反应分析解答,难点是电极反应式的书写,题目难度中等,侧重于考查学的分析能力和计算能力.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
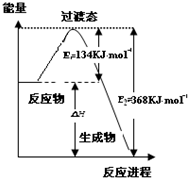 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 银器为正极,Ag2S被氧化生成单质银 | |
| C. | 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 g Fe投入到400 mL 1 mol/L的硝酸中充分反应,转移电子总数为0.2 NA | |
| B. | 标准状况下,11.2 L C2H6含3 NA个C-H极性共价键 | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | SO2通入碘水中,反应的离子方程式为:SO2+I2+2H2O═SO32-+2I-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
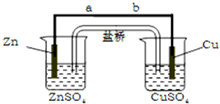
科目:高中化学 来源: 题型:选择题
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com