
| A. | Na2O2 | B. | CO2 | C. | SO2 | D. | C2H4 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2017届内蒙古高三上月考二化学试卷(解析版) 题型:选择题
下列关于氧化还原反应说法正确的是
A.肯定一种元素被氧化,另一种元素被还原
B.某元素从化合态变成游离态,该元素一定被还原
C.在反应中不一定所有元素的化合价都发生变化
D.在氧化还原反应中非金属单质一定是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
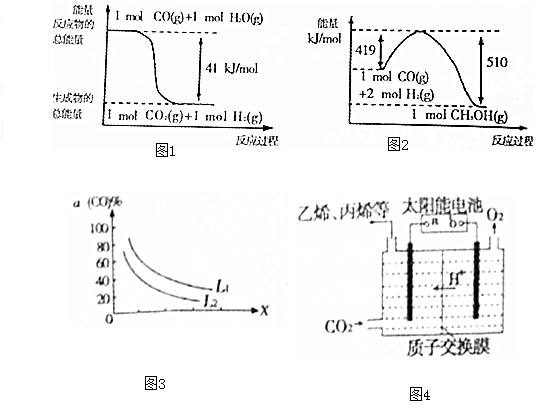
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
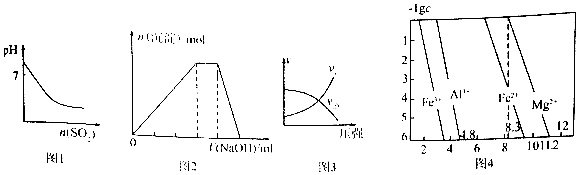
| A. | 图1表示常温下,将SO2气体通入溴水中,所得溶液pH的变化 | |
| B. | 图2表示向NH4A1(SO4)2溶液中逐滴滴入NaOH溶液,沉淀总物质的量(n)随NaOH溶液体积(V)的变化 | |
| C. | 图3表示T°C时,对于可逆反应:A(g)+B(g)?2C(g)+D(g)△H>0,正、逆反应速率与压强的关系 | |
| D. | 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH=7的溶液中,Fe3+、A13+、Fe2+能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝热反应 | ||
| C. | 铝与稀盐酸 | D. | 灼热的炭与CO2反应 |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟二化学试卷(解析版) 题型:选择题
能正确表示下列反应离子方程式的是( )
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
B.双氧水中加入稀硫酸和KI溶液:2I﹣+H2O2+2H+=I2+O2↑+2H2O
C.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42﹣+Ba2++3OH﹣=Fe(OH)3↓+BaSO4↓
D.草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4+2MnO4﹣+6H+=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液 | B. | FeCl3溶液 | C. | NaCl溶液 | D. | Cu(NO3)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com