


科目:高中化学 来源: 题型:
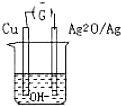 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
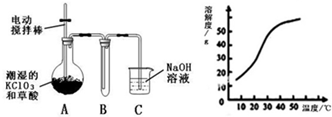 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com