
| A. | 放热反应的反应速率一定大于吸热反应的反应速率 | |
| B. | 熔融状态下能导电的化合物一定含离子键 | |
| C. | 增大反应物浓度可加快反应速率,因此可用浓硫酸与锌反应增大生成氢气的速率 | |
| D. | 是否有丁达尔现象是胶体和溶液的本质区别 |
分析 A.反应速率与反应物的性质及反应条件有关;
B.熔融状态下能导电的化合物中含自由移动的离子;
C.浓硫酸与铁反应不生成氢气;
D.分散系本质区别为分散质微粒直径大小.
解答 解:A.反应速率与反应物的性质及反应条件有关,与反应过程中的放热、吸热无关,故A错误;
B.熔融状态能导电的化合物一定是离子化合物,只有离子化合物在熔融状态下电离出自由移动的离子,一定含离子键,故B正确;
C.浓硫酸具有强氧化性,与铁反应不生成氢气,故C错误;
D.分散系本质区别为分散质微粒直径大小,是否有丁达尔现象是胶体和溶液的鉴别方法,不是本质特征,故D错误;
故选B.
点评 本题考查影响反应速率的因素,浓硫酸的性质,胶体的性质,题目难度不大,注意胶体本质区别为分散质微粒直径大小.


科目:高中化学 来源: 题型:解答题
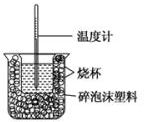 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、NaOH、KOH的碱性依次减弱 | ||
| C. | NH3、H2O(气态)、HF的稳定性依次减弱 | D. | Cl2、Br2、I2的氧化性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
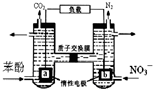 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )| A. | a为正极 | |
| B. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| C. | 左池电极反应式为C6H6O+11H2O-28e-═6CO2↑+28H+ | |
| D. | 左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个甘氨酸分子中存在9对共用电子对(甘氨酸的结构简式为NH2-CH2-COOH) | |
| B. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2S和CS2分子都是含极性键的极性分子 | |
| D. | 正四面体分子中键角可能是109°28′或60° |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;KCl第电子式
;KCl第电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7 g的羟基中含有的电子数为NA | |
| B. | 标准状况下,11.2 L四氯化碳所含的原子数为2NA | |
| C. | 常温常压下,18 g H2O含有的原子数为3NA | |
| D. | 5.6 g金属铁变为离子时失去的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定不含有FeCl2,含有少量AlCl3 | |
| C. | 混合物中含有0.05molMgCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com