
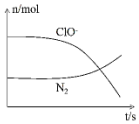
 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )| A. | 该反应中Cl-为氧化产物 | B. | 消耗1 mol还原剂,转移6 mol电子 | ||
| C. | 反应后溶液的酸性减弱 | D. | NH4+被ClO-氧化成N2 |
分析 由曲线变化图可知,随反应进行N2的物质的量增大,故N2是生成物,则NH4+应是反应物,N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4++2OH-=N2↑+5H2O+3Cl-,以此解答该题.
解答 解:反应的方程式应为3ClO-+2NH4++2OH-=N2↑+5H2O+3Cl-,
A.由方程式可知,N元素的化合价升高,则N2为氧化产物,故A错误;
B.N元素化合价由-3价升高到0价,则消耗1mol还原剂,转移3mol电子,故B错误;
C.反应在碱性条件下发生,反应消耗OH-,反应后溶液的碱性减弱,故C错误;
D.由方程式可知,NH4+被ClO-氧化成N2,故D正确.
故选D.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 结论 |
| A | 相同条件下,分别测量0.1mol/L和0.01mol/L的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 向Co2O3固体中滴加浓盐酸,有黄绿色气体生成 | 氧化性:Co2O3>Cl2 |
| C | 向淀粉溶液中滴加少量稀硫酸,水浴加热一段时间后冷却,向溶液中滴加碘水,溶液变蓝 | 淀粉未发生水解 |
| D | 常温下,分别测量浓度均为0.1mol/L的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 100 g含氢元素质量分数为12%的乙烯和乙醛(C2H4O)的混合物中,所含氧原子数目NA | |
| C. | 实验室制氯气的化学方程式:KClO3+6H37Cl(浓)═KCl+337Cl2↑+3H2O | |
| D. | 2.0 L 0.5 mo1/L NaAlO2溶液中含有氧原子的数目为 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键 | |
| B. | 在水溶液中能导电的化合物一定是离子化合物 | |
| C. | 共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏 | |
| D. | 含有离子键的物质不可能是单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 molHC1和1 molKOH的两种稀溶液混合 | |
| B. | 含1 molHC1和0.5 molKOH 的两种稀溶液混合 | |
| C. | 含0.5mo溶质的浓硫酸和含1mol溶质KOH溶液混合 | |
| D. | 向0.5 mol溶质的浓硫酸和含2mol溶质的KOH溶液混合向1 molNa0H烧碱固体中加入足量1 mol•L-1的硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com