
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 充电 |
| 放电 |
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| 0.2×0.42 |
| 0.62×1.62 |
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| 0.8×0.42 |
| 1.62×1.22 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、中性溶液的PH都相等 | ||||
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 | ||||
C、
| ||||
| D、△H<0,△S<0的化学反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、苯与溴水反应生成溴苯 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

 利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为
利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为查看答案和解析>>
科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
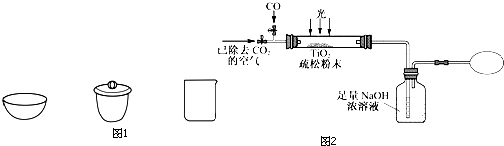
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H6 |
| ②H2O2/OH- |

查看答案和解析>>
科目:高中化学 来源: 题型:

 、
、 、
、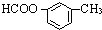 、
、查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 金属 状态 | c(H2SO4) /mol?L-1 | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 丝 | 0.7 | 20 | 36 | 250 |
| 2 | 丝 | 0.8 | 20 | 35 | 200 |
| 3 | 粉末 | 0.8 | 20 | 35 | 25 |
| 4 | 丝 | 1.0 | ? | 35 | 125 |
| 5 | 丝 | 1.0 | 35 | 50 | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com