
| A. | 其单质的熔点比钠的熔点低 | B. | 其氧化物对应的水化物的碱性很强 | ||
| C. | 其原子半径在同一主族中是最大的 | D. | 在空气中燃烧只能生成Fr2O |
分析 Fr属于碱金属元素,位于第七周期,根据同主族元素性质的相似性和递变性,钠和钫位于周期表相同主族,钫的原子半径大,金属性较强,熔点较低,以此解答该题.
解答 解:A.原子半径逐渐增大,则金属键逐渐减弱,钫的熔点较低,故A正确;
B.Fr在碱金属中元素的金属性最强,对应的氧化物的水化物的碱性极强,故B正确;
C.同主族元素从上到下原子半径逐渐增大,则Fr在碱金属元素中具有最大的原子半径,故C正确;
D.在碱金属元素中只有Li生成Li2O,其它元素对应的单质能生成氧化物、过氧化物、超氧化物等,故D错误;
故选D.
点评 本题考查同主族元素的性质的递变规律,为高频考点,侧重于学生的分析能力的考查,注意把握元素的性质与对应单质、化合物的性质的递变性和相似性的判断,难度不大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属单质M能从N的化合物中置换出非金属单质N | |
| B. | 在反应中M原子比N原子得到更多电子 | |
| C. | M的气态氢化物稳定性比N弱 | |
| D. | M的氧化物对应水化物的酸性比N强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验式 CH2 | B. | 结构简式 CH2=CHCH3 | ||
| C. | 球棍模型: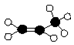 | D. | 加聚反应后的结构简式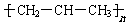 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式为SiO2 | B. | 2-丁烯的键线式: | ||
| C. | 丙烷分子的球棍模型示意图: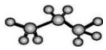 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
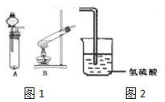 某研究性学习小组设计了一组实验来验证元素周期律.
某研究性学习小组设计了一组实验来验证元素周期律.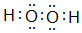 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )
如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )| A. | b为电源的正极,d点周围变红 | B. | Cu电极质量减小,Pt电极质量增大 | ||
| C. | Z中溶液的pH先减小,后增大 | D. | 溶液中的SO42-向Pt电极定向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com