
| A、c(OH-)=10-2mol?L-1 |
| B、加入少量NaOH固体,c(Na+)和c(CO32-)均增大 |
| C、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| D、2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
| A、处理废水时加入明矾作为消毒剂可以除去水中的杂质 |
| B、为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 |
| C、金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当pH>7 时,c(C6 H5O-)>c(K+)>c(H+)>c(OH-) |
| B、当pH<7 时,c(K+)>c(C6 H5 O-)>c(H+)>c(OH-) |
| C、V[C6 H5OH(aq)]=10 mL 时,c(K+)=c(C6 H5 O-)>c(OH-)=c(H+) |
| D、V[C 6H5OH (aq)]=20 mL 时,c(C6 H5O-)+c(C6H5OH)=2c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光化学烟雾指的是排入大气的氮氧化物和碳氢化合物发生光反应而形成的污染物 |
| B、室内空气污染主要源于装饰材料及粘合剂散发的甲醛等有毒气体 |
| C、某酸雨样品在空气中露置后pH值由4.5变为4.3其原因可能是吸收了空气中的CO2 |
| D、绿色食品是指天然无污染食品,白色食品是指经发酵而得的食品,蓝色食品是指来自海洋的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、NO3- |
| B、NO3- |
| C、SO32-、NO3- |
| D、CO32-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B、室温下,pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+) |
| C、0.lmol/L CH3COOH溶液与0.1 molNaOH溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) |
| D、CH3COONa溶液与CH3COOH溶液等物质的量混合后溶液呈酸性,所得溶液中:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | H2CO3 | 水杨酸(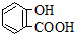 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | K a1=1.3×10-3 K a2=1.1×10-13 |
A、常温下,等浓度、等体积的NaHCO3溶液pH小于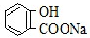 溶液pH 溶液pH |
B、常温下,等浓度、等体积的Na2CO3溶液和 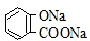 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 |
C、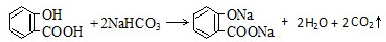 |
| D、水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是能形成分子内氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、X与氧气反应可生成不止一种氧化物 |
| B、原子半径:W>Z>Y>X |
| C、气态氢化物稳定性:HmZ>HnW |
| D、W位于第3周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝的表面能形成致密的氧化膜,因此铝难腐蚀 |
| B、铝能溶解于冷的浓硝酸氧化成为硝酸铝 |
| C、铝能溶解于NaOH溶液生成偏铝酸钠和氢气 |
| D、铝能在氯气中燃烧,生成氯化铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com