
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 22.20 |
| 第二次 | 20.00 | 1.56 | 25.50 |
| 第三次 | 20.00 | 0.22 | 22.48 |
分析 (1)滴定操作中,首先需要检漏,然后洗涤仪器、润洗滴定管,再向滴定管中装入溶液,最后进行滴定,据此对各操作进行排序;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;溶液颜色由黄色突变为橙色,且半分钟内不变色,达到终点;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)先判断数据的合理性,然后盐酸溶液的平均体积,然后根据HCl~NaOH求氢氧化钠的物质的量浓度.
解答 解:(1)中和滴定中,按照检漏、洗涤、润洗、装液、滴定等操作进行,则正确的滴定顺序为:③⑤①②④,
故答案为:B;
(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不变色,
故答案为:锥形瓶内溶液颜色的变化;溶液颜色由黄色突变为橙色,且半分钟内不变色;
(3)A.锥形瓶用蒸馏水洗净后再用待测液润,使参加反应的待测液增多,消耗的V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏高,故A正确;
B.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏高,故B正确;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏高,故C正确;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏低,故D错误;
故答案为:ABC;
(4)三次消耗的盐酸的体积为22.20mL,23.94mL,22.26mL,第二次舍去,其他两次溶液的平均体积为22.23mL,NaOH溶液的体积为20.00mL,
HCl~~~~~~~NaOH
1 1
0.1000mol•L-1×22.23mL C(NaOH)×20.00mL
解得:C(NaOH)=0.1112mol/L,
故答案为:0.1112mol/L.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度适中,理解中和滴定的原理是解题关键.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能直接转变为电能的装置 | |
| B. | 原电池负极发生的电极反应是还原反应 | |
| C. | 原电池在工作时其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池的电极只能由两种不同的金属构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
| A. | △H=+102kJ/mol | B. | △H=-102kJ/mol | C. | △H=+267kJ/mol | D. | △H=-267kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
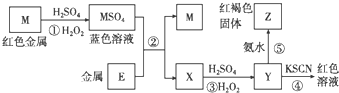
| A. | E2+的氧化性比M2+的氧化性强 | |
| B. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| C. | 反应④的离子方程式可表示为:E3++3SCN-?E(SCN)3↓ | |
| D. | 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
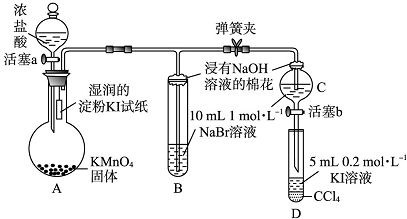
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
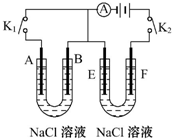 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油、柴油和地沟油都是碳氢化合物 | |
| B. | 石油的分馏和煤的干馏都是化学变化 | |
| C. | 苯环内含有碳碳单键和碳碳双键 | |
| D. | 纤维素、淀粉、蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓H2SO4 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
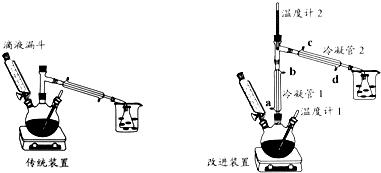
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com