
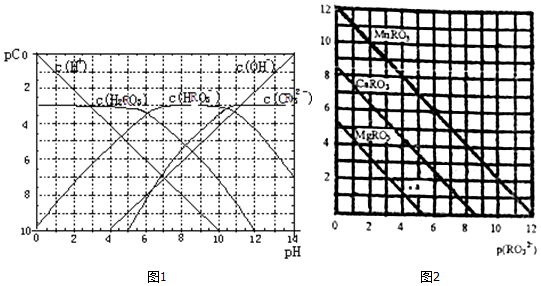
分析 (1)在pH=2~4时从图形分析判断,主要存在微粒为H+、HRO3-、H2RO3;
(2)H2RO3一级电离平衡常数Ka1=$\frac{c({H}^{+})c(HR{{O}_{3}}^{-})}{c({H}_{2}R{O}_{3})}$,结合图象数据计算;
(3)观察图1判断NaHRO3溶液PH大于7溶液显碱性;利用电离、水解平衡常数计算分析判断;
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,溶液中存在电离平衡和水解平衡,相互抑制,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大;
(5)①溶度积常数=c(M2+)c(RO32-),图象分析可知大小;
②a点可表示MgRO3的不饱和溶液,p(M2+)<p(RO32-),pM数值越小,实际浓度越大;
③图象计算溶度积常数Ksp=c(Mn2+)c(RO32-)=10-12,将某溶液中的Mn2+以MnRO3盐的形式沉淀完全,溶液中Mn2+离子的浓度小于l×10-5mol/L,计算得到RO32-浓度,得到p(RO32-)的范围;
解答 解:(1)在pH=2~4时,H2RO3溶液中主要存在的离子为H+、HRO3-,
故答案为:H+、HRO3-;
(2)H2RO3一级电离平衡常数随温度变化,不随浓度变化,图象中分析可知Ka1=$\frac{c({H}^{+})c(HR{{O}_{3}}^{-})}{c({H}_{2}R{O}_{3})}$=c(H+)=1×10-6,
故答案为:1×10-6;
(3)已知:298K时,H2RO3的电离常数Ka2=5.6×10-11.观察图1判断NaHRO3溶液呈碱性,水解为:HRO3-+H2O?H2RO3+OH-,Kh=$\frac{c({H}_{2}R{O}_{3})c(O{H}^{-})}{c(HR{{O}_{3}}^{-})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8>Ka2,HRO3-水解程度大于电离程度,故溶液呈碱性,
故答案为:碱性;Kh=$\frac{c({H}_{2}R{O}_{3})c(O{H}^{-})}{c(HR{{O}_{3}}^{-})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8>Ka2,HRO3-水解程度大于电离程度,故溶液呈碱性;
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是:在该溶液中加入少量的酸,使平衡:HRO3-?H++RO32-向左移动,结果溶液中H+浓度增加很少;若在溶液中加入少量的碱,使平衡HRO3-?H++RO32-向右移动,结果溶液中OH-浓度也增加不大,
故答案为:在该溶液中加入少量的酸,使平衡:HRO3-?H++RO32-向左移动,结果溶液中H+浓度增加很少;若在溶液中加入少量的碱,使平衡HRO3-?H++RO32-向右移动,结果溶液中OH-浓度也增加不大;
(5)①溶度积常数=c(M2+)c(RO32-),MgRO3、CaRO3、MnRO3的Ksp由大到小的顺序为Ksp(MgRO3)>Ksp(Ca RO3)>Ksp(Mn RO3),
故答案为:Ksp(MgRO3)>Ksp(Ca RO3)>Ksp(Mn RO3);
②a点可表示MgRO3的不饱和溶液,p(M2+)<p(RO32-),pM数值越小,实际浓度越大;图象可知c(Mg2+)>c(RO32-),此时MgRO3溶液未达到饱和溶液,
故答案为:>,未达饱和;
③图象计算溶度积常数Ksp=c(Mn2+)c(RO32-)=10-12,将某溶液中的Mn2+以MnRO3盐的形式沉淀完全,溶液中Mn2+离子的浓度小于l×10-5mol/L,计算得到RO32-浓度c(RO32-)=10-7mol/L,得到p(RO32-)的范围<7,
故答案为:<7;
点评 本题考查了弱电解质电离平衡、盐类水解、电离平衡常数计算和溶度积常数计算,主要是图象的分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
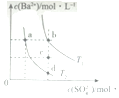
| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
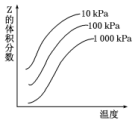 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③>①>② | D. | 最高化合价:②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,氯气的摩尔质量等于71g | |
| B. | 1molH2SO4中含有2mol氢元素 | |
| C. | 某物质的摩尔质量就是该物质的相对分子质量或相对原子质量 | |
| D. | 2g氦气所含的原子数目约为0.5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 反应温 度/℃ | Na2S2O3溶液 | 稀硫酸 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 即将发射的嫦娥五号卫星使用的碳纤维是一种新型无机非金属材料 | |
| B. | 我国古代闻名于世界的化学工艺有烧陶瓷、造纸、冶金、制火药等 | |
| C. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的氮氧化物 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com