
| A. | 达到化学平衡时,速率关系为:v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6 | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态 | |
| C. | 达到化学平衡时,若增加体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到化学平衡时v正(O2):v逆(NO)=5:4 |
分析 A.化学反应速率与化学计量数成正比;
B.表示的都是正反应速率,无法判断平衡状态;
C.若增加体积,压强减小,正逆反应速率都减小;
D.表示的是正逆反应速率,且满足化学计量数关系.
解答 解:A.达到化学平衡时,反应速率与化学计量数成正比,则反应速率关系为:v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6,故A正确;
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,表示的都是正反应速率,且不满足计量数关系,无法判断平衡状态,故B错误;
C.达到化学平衡时,若增加体积,容器内压强减小,正逆反应速率都减小,故C错误;
D.达到化学平衡时v正(O2):v逆(NO)=5:4,表明正逆反应速率,达到了平衡状态,故D正确;
故选AD.
点评 本题考查化学平衡状态的特征与判断,难度中等,注意理解化学平衡状态,选择判断化学平衡的物理量,应随反应进行发生变化,该物理量由“变化”到“不变化”,说明到达平衡.


科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
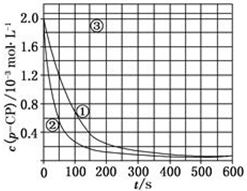 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电电池可以无限制的反复充电、放电 | |
| B. | 充电电池的化学原理是氧化还原反应 | |
| C. | 较长时间不使用电器时,最好将电器中电池取出,并妥善存放 | |
| D. | 充电是放电时的氧化还原反应逆向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

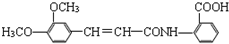 ).
).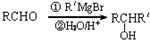
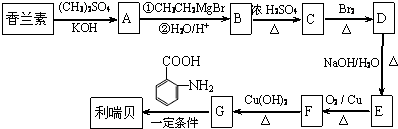
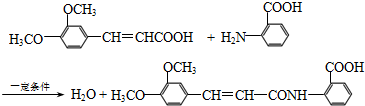
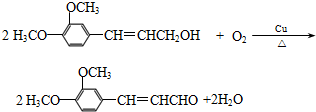
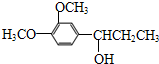 .
.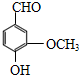 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 生石灰与水的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com