
下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1”可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)===2H2O(l) ΔH=+285.8 kJ·mol-1
D.在稀溶液中:H++OH-===H2O ΔH=-57.3 kJ·mol-1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L Cl2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类合理的是
A.氧化物:CuO、NO、SO2、H2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.碱性氧化物:Na2O、CaO、Al2O3、Na2O2
D.电解质:KNO3 、Cl2、HCl 、BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而
且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式是 。
(2)方法二中被还原的物质是 ,若反应中产生的ClO2气体在标准状况下的体积为2.24L,则电子转移数为 NA。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:1,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不能用平衡移动原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾 Na(l)+KCl(l)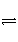
 NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)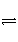
 H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=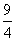 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI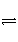
 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
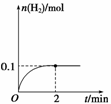
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)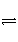
 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l)
ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1)有下列四种微粒:①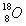 ②
② ③
③ ④
④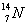 (用序号填空)
(用序号填空)
I.按原子半径由大到小顺序排列是_________________。
II.微粒中质子数小于中子数的是________________。
III.在化合物中呈现的化合价的数值最多的是 ________________。
IV.能形成X2Y2型化合物的是____________,能形成X3Y2型化合物的是____________。
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的离子半径由大到小的顺序是__ ________,原子序数由大到小的顺序是_ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,,丁与辛属同周期元素,
 (1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(2)用元素符号表示辛、己、戊的原子半径从大到小的顺序 ;
(3)丙与庚的原子核外电子数相差 ;
(4)戊单质电子式为 ,写出一种含戊、己两种元素的离子化合物的化学式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com