
| A、HCO3-离子数略多于CO32-离子数 |
| B、HCO3-离子数等于CO32-离子数 |
| C、HCO3-离子数略少于CO32-离子数 |
| D、Na+离子数等于HCO3-离子数和CO32-离子数之和 |
| 4.48L |
| 22.4L/mol |
| 4.48L |
| 22.4L/mol |
|


科目:高中化学 来源: 题型:
| A、64g SO2含有氧原子数为NA |
| B、0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
| C、标准状况下,22.4L H2O的分子数为NA |
| D、常温常压下,14g N2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷和丙烯 |
| B、乙酸和葡萄糖 |
| C、乙炔和丁烯 |
| D、乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、x=30时,溶液中有Ba2+、Al
| ||||||||||
| B、x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+) | ||||||||||
C、x=10时,溶液中有N
| ||||||||||
D、x=10时,溶液中有N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
| A、实验1中溶解的金属是铁且质量为4.2g |
| B、实验2中4.8g金属的组成是铁与铜 |
| C、实验4发生反应的离子方程式:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| D、实验4中V的数值为4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
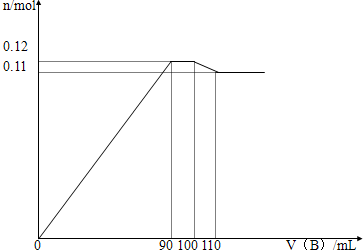
| 溶质 | c/mol?L-1 |
| Na2SO4 | |
| NaOH | |
| BaCl2 | |
| AlCl3 | |
| FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲 | B、乙 | C、丙 | D、丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com