
 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是| A.①④⑥⑦ | B.②③⑤⑦ |
| C.①③④⑤ | D.全部 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源:不详 题型:单选题
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A.①③ | B.②④ | C.①②③ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.vA=0.15mol/(L?min) | B.vB=0.6mol/(L?s) |
| C.vC=0.2mol/(L?min) | D.vD=0.01mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.④>③=②>① | B.③=②<④<① | C.①>②>③>④ | D.④>③>②>① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
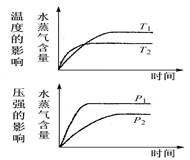
 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是| A.容器内压强不再改变 | B. (H2O)= (H2O)= (H2) (H2) |
| C.气体的密度不再改变 | D.反应不再进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CO2(g)+2NH3( g) CO(NH2)2(s)+H2O(g); △H<0 CO(NH2)2(s)+H2O(g); △H<0 |
B.CO2(g)+ H2(g)  CO(g)+H2O(g); △H>0 CO(g)+H2O(g); △H>0 |
C.CH3CH2OH CH2=CH2(g)+ H2O(g); △H>0 CH2=CH2(g)+ H2O(g); △H>0 |
D.2C6H5CH2CH3(g)+O2(g) 2C6H-5CH=CH2(g)+2H2O(g); △H<0 2C6H-5CH=CH2(g)+2H2O(g); △H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
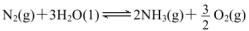
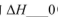 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
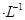 盐酸与0.2 mol
盐酸与0.2 mol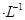 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数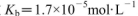 )
)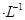 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol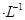 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol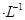 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,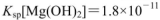 ,
,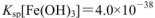 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com