
| A、c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br-- |
| B、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C、Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| D、pH=12的溶液中:NO3-、I-、Na+、Al3+ |


科目:高中化学 来源: 题型:
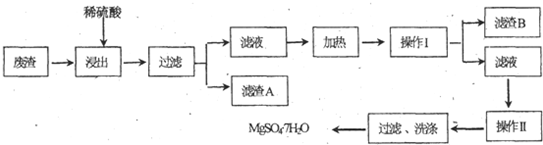

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌 |
| B、将10g98%的浓硫酸沿烧杯壁慢慢注入盛有25mL水的烧杯中,并用玻璃棒不断搅拌 |
| C、若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28% |
| D、配制该溶液时,若有浓硫酸沾到手上应立即用氢氧化钠溶液中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+ |
| B、滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+ |
| C、滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+ |
| D、滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com