
分析 (1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式;同一其元素元素,电负性随着原子序数增大而增大;化合物中各元素化合价的代数和为0,该化合物中N元素化合价为-3价,据此判断B元素化合价;
(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构;
根据价层电子对互斥理论确定原子杂化方式、微粒空间构型,BF3分子中B原子价层电子对个数是3且不含孤电子对,BF4-中B原子价层电子对个数是4且不含孤电子对;
(3)不同非金属元素之间易形成极性键;分子之间存在分子间作用力;
(4)该晶胞中如果C原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上C原子连接一个N原子;
该晶胞边长=361.5pm=361.5×10-10cm,体积=(361.5×10-10cm)3,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式1s22s22p1;
同一其元素元素,电负性随着原子序数增大而增大,所以电负性N>B;
化合物中各元素化合价的代数和为0,该化合物中N元素化合价为-3价,则B元素化合价为+3价,
故答案为:1s22s22p1;N;+3;
(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构,则F-B-F的键角是120°;
根据价层电子对互斥理论确定原子杂化方式、微粒空间构型,BF3分子中B原子价层电子对个数是3且不含孤电子对,BF4-中B原子价层电子对个数是4且不含孤电子对,所以BF3分子中B采用sp2杂化、BF4-是正四面体结构,
故答案为:120°;sp2;正四面体;
(3)不同非金属元素之间易形成极性键,所以B-N原子之间存在极性键;分子之间存在分子间作用力,所以层之间存在分子间作用力,
故答案为:极性键;分子间作用力;
(4)该晶胞中如果C原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上C原子连接一个N原子,所以该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、N原子个数为4;
该晶胞边长=361.5pm=361.5×10-10cm,体积=(361.5×10-10cm)3,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{25}{{N}_{A}}×4}{(361.5×1{0}^{-10})^{3}}$g•cm-3=$\frac{100}{(361.5×1{0}^{-10})^{3}{N}_{A}}$g•cm-3,
故答案为:4;4;$\frac{100}{(361.5×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断、原子核外电子排布等知识点,这些都是高频考点,难点是晶胞密度计算,知道密度公式中各个字母含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑥⑦ | C. | ②④⑦ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥⑦ | C. | ①②④⑤⑨ | D. | ①②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
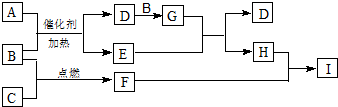
 、E的结构式H-O-H、F的化学式为Fe3O4.
、E的结构式H-O-H、F的化学式为Fe3O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
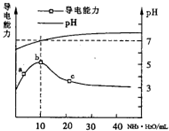 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)×c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
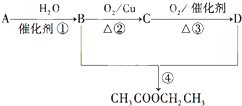 已知:
已知: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com