
| A. | 150 mL 2 mol•L-1盐酸 | B. | 150 mL 2 mol•L-1硫酸 | ||
| C. | 500 mL 3 mol•L-1盐酸 | D. | 500 mL 18.4 mol•L-1浓硫酸 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | KI | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(AgI) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、强氧化性 | |
| C | 稀盐酸 | Na2SO3 | KMnO4溶液 | SO2有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | / | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | / | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a(A-N+m)}{A+m}$mol | B. | $\frac{a(A-N)}{A+m}$ mol | C. | $\frac{a(A-N+m)}{A+2m}$mol | D. | $\frac{a(A-N+m)/}{A}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该分子中所有氢原子不可能在同一平面上 | |
| B. | 1mol该物质与氢气反应,最多消耗4mol氢气 | |
| C. | 加入FeCl3溶液呈紫色,因为该物质含有酚类结构特征 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,可证明结构存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
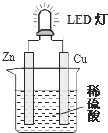 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )| A. | 装置中存在“化学能→电能→光能”的转换 | |
| B. | 铜片上发生的反应为:2H++2e-=H2 | |
| C. | 如果将硫酸换成柠檬汁,导线中不会有电子流动 | |
| D. | 如果将锌片换成铁片,电路中的电流方向不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电极材料必须是金属材料 | |
| B. | 若a极为铜条、b极为锌片,c为蔗糖溶液时,灯泡会发亮 | |
| C. | 若a极为铝条、b极为铜片,c为浓硝酸溶液时,铜为负极 | |
| D. | 若a极为铝条、b极为镁片,c为稀硫酸溶液时,铝为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com