
| 实验用品 | 溶液 体积* | 溶液温度 | 中和热(△H) | ||
| t1 | t2 | ||||
| a | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.3℃ | |
| 0.5 mol?L-1 HCl溶液 | 50 mL | ||||
| b | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.5℃ | |
| 0.5 mol?L-1 HCl 溶液 | 50 mL | ||||
. |
| △t |
| Q |
| n |
| 1.4212KJ×1mol |
| 0.025mol |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
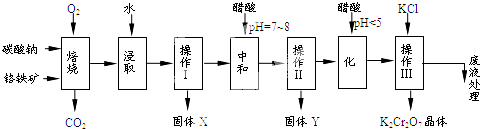
| 750℃ |
| 750℃ |
| 物质 | 溶解度/(g/100g水) | ||
| 0℃ | 40℃ | 80℃ | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:
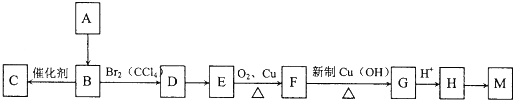
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用AlCl3与纯HNO3反应 |
| B、用AlCl3溶液与Ba(NO3)2溶液反应 |
| C、用AlCl3溶液与NaOH反应,过滤得沉淀再加HNO3 |
| D、用AlCl3溶液与氨水反应,过滤得沉淀再加HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
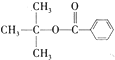 ),注:部分物质省略.
),注:部分物质省略.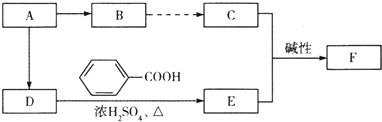

查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.| 氯气,点燃 |
| ① |
| 少量水 |
| ② |
| 氨气 |
| ③ |
| 氨气 |
| ④ |
| H2S |
| ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾是一种复盐,则NaAlO2也是一种复盐 |
| B、CaCO3的溶解度小于Ca(HCO3)2,则Na2CO3的溶解度小于NaHCO3 |
| C、在Ca(ClO)2溶液中分别通入CO2、SO2,前者生成CaCO3沉淀,则后者也生成CaSO3沉淀 |
| D、S、Cl两种元素为同周期元素,H2SO4为强酸,则HClO4也为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
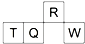 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径:Q>T>R |
| B、最高价氧化物对应水化物的酸性:Q<W |
| C、气态氢化物的稳定性:R>Q |
| D、Q的氧化物只能与碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com