
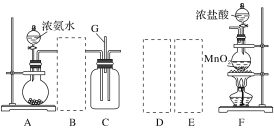
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O ACE Ⅱ Ⅲ Ⅰ 8NH3+3Cl2=6NH4Cl+N2 用试管取少量固体,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明该白色固体中的阳离子为NH4+
Mn2++Cl2↑+2H2O ACE Ⅱ Ⅲ Ⅰ 8NH3+3Cl2=6NH4Cl+N2 用试管取少量固体,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明该白色固体中的阳离子为NH4+
【解析】
(1) 浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水;
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应;
(3)氨气和氯气均需要干燥,且氯气中混有HCl;
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,由此写出反应方程式;
(5)鉴定氯化铵中铵根离子,利用与浓NaOH反应生成氨气的性质判断。
(1)装置F中浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,发生反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2) A.碱石灰、C.生石灰、E烧碱都是碱性物质,且碱石灰、生石灰、氢氧化钠溶于水放出大量的热,使溶液温度升高,有利于NH3H2O分解,有氨气逸出,则可以用来制备氨气,而D.五氧化二磷、B.浓硫酸虽然溶于水时放热,但是酸性物质,能与NH3H2O反应生成铵盐,无氨气逸出,故答案为A、C、E;
(3) 氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故选Ⅱ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅰ;水蒸气常用浓硫酸除去,故D选Ⅲ;
(4) 氯气和氨气在常温下混合,发生反应生成氯化铵和氮气的化学方程式为8NH3+3C12=6NH4C1+N2;
(5)检验白色固体中的阳离子的方法是用试管取少量固体,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明该白色固体中的阳离子为NH4+。


科目:高中化学 来源: 题型:
【题目】二茂铁分子[Fe (C5H5)2]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是( )
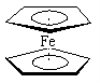
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.1mol环戊二烯(![]() )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
C.二茂铁分子中存在π键
D.Fe2+的电子排布式为1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
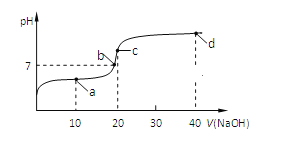
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
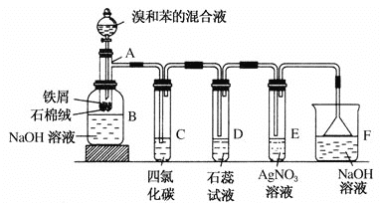
填写下列空白:
①试管A中的反应方程式为______________。
②试管C中四氯化碳的作用是:____________________________。反应开始后,观察D试管,看到的现象为:_______________。写出E中反应的离子方程式______________。
③反应2~3 min后,在B中的NaOH溶液里可观察到的现象是____________。
④在上述整套装置中,具有防倒吸功能的仪器有________(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55~60 ℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。请填写下列空白:
①制备硝基苯的反应类型是________。
②配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是:_____________。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是_________________。
④步骤d中粗产品用5%NaOH溶液洗涤的目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)FeCl3的水溶液呈___(填“酸性”、“碱性”或“中性”),原因是_____(用离子方程式表示);实验室配制FeCl3的水溶液时,需加入______;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(II)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3处
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如图所示,其读数为_______mL。

(2)根据下列数据:

请计算待测烧碱溶液的浓度为______mol/L。
(3)下列实验操作会使实验结果偏高的是_______。
A.锥形瓶用待测液润洗后再注入待测液
B.酸式滴定管未用标准液润洗,便装入标准液
C.酸式滴定管滴定前俯视读数,滴定后仰视读数
D.酸式滴定管滴定前有气泡,滴定后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型示意图,下列说法正确的是
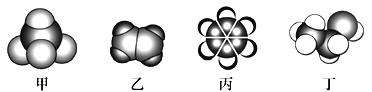
A. 甲能发生氧化反应
B. 乙通入溴的四氯化碳溶液,最后得到无色溶液不能和液溴反应
C. 煤干馏得到的煤焦油可以分离出丙,丙是无色无味的液态烃
D. 丁发生催化氧化得到的产物不能与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上,对过氧化氢的分子结构有过不同观点,下图两种对结构的猜测中有一种正确,请选用合理实验加以证明
猜想Ⅰ: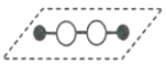 猜想Ⅱ:
猜想Ⅱ: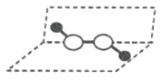
A.测定过氧化氢的沸点
B.测定过氧化氢分解时吸收的能量
C.测定过氧化氢分子中的氢氧键与氧氧键键长
D.观察过氧化氢细液流在电场中是否发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com