

分析 (1)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
由盖斯定律可知,①+②×$\frac{1}{2}$-③×$\frac{1}{2}$得CO(g)+2H2(g)?CH3OH(g);
(2)在300℃到500℃时,物质的量n(CH3OH)减小,平衡逆向移动,逆反应是吸热反应;
(3)A.缩小容器体积,增大压强,平衡正向移动;
B.该反应为放热反应,降低温度,平衡正向移动;
C.升高温度,平衡逆向移动;
D.催化剂不影响平衡移动;
E.将甲醇从混合体系中分离出来,生成物浓度减小,平衡正向移动;
(4)CH4和H2O在催化剂表面发生反应CH4+H2O?CO+3H2,T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,
CH4+H2O?CO+3H2
起始物质的量浓度(mol•L-1) 1.0 1.0 0 0
转化物质的量浓度(mol•L-1) 0.5 0.5 0.5 1.5
平衡物质的量浓度(mol•L-1 0.5 0.5 0.5 1.5
结合平衡浓度计算K;
(5)负极上甲醇失电子生成二氧化碳;
(6)碳酸钙溶液中钙离子浓度为$\sqrt{2.5×1{0}^{-9}}$mol/L=5×10-5mol/L,二者混合后,钙离子浓度=2.5×10-5mol/L,草酸钾浓度为4.0×10-4mol/L,结合Qc与Ksp判断.
解答 解:(1)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
由盖斯定律可知,①+②×$\frac{1}{2}$-③×$\frac{1}{2}$得CO(g)+2H2(g)?CH3OH(g),则△H=△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3,
故答案为:△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(2)在300℃到500℃时,物质的量n(CH3OH)减小,平衡逆向移动,逆反应是吸热反应,正反应是放热反应,即△H<0,
故答案为:<;
(3)A.缩小容器体积,增大压强,平衡正向移动,甲醇的产率增加,故正确;
B.降低温度,平衡正向移动,甲醇的产率增加,故正确;
C.升高温度,平衡逆向移动,甲醇的产率减少,故错误;
D.使用合适的催化剂,平衡不移动,故错误;
E.将甲醇从混合体系中分离出来,有利平衡正向移动,提高甲醇的产量,故正确;
故答案为:A B E;
(4)CH4和H2O在催化剂表面发生反应CH4+H2O?CO+3H2,T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,
CH4+H2O?CO+3H2
起始物质的量浓度(mol•L-1) 1.0 1.0 0 0
转化物质的量浓度(mol•L-1) 0.5 0.5 0.5 1.5
平衡物质的量浓度(mol•L-1 0.5 0.5 0.5 1.5
K=$\frac{0.5×1.{5}^{3}}{0.5×0.5}$=6.75mol2/L2,
故答案为:6.75;
(5)由原电池原理可知,负极上甲醇失电子生成二氧化碳,电极反应为CH3OH+3O2--6e-=CO2+2H2O,
故答案为:CH3OH+3O2--6e-=CO2+2H2O;
(6)碳酸钙溶液中钙离子浓度为$\sqrt{2.5×1{0}^{-9}}$mol/L=5×10-5mol/L,二者混合后,钙离子浓度=2.5×10-5mol/L,草酸钾浓度为4.0×10-4mol/L,混合后c(Ca2+)•c(C2O42-)=2.5×10-5×4.0×10-4=1×10-8<Ksp(4.0×10-8),故无沉淀,
故答案为:否.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡移动、电极反应、沉淀生成、盖斯定律应用为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:填空题
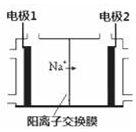 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
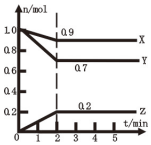 (1)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.
(1)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
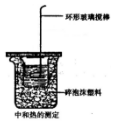 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com