
分析 (1)高锰酸钾稀溶液是一种常用的消毒剂,是由于高锰酸钾具有强氧化性;
(2)K2MnO4在酸性条件下全转变为MnO2和KMnO4,同时生成水,根据电子转移守恒、电荷守恒、原子守恒配平;
(3)①根据n=cV计算的物质的量,再根据m=nM计算Na2S2O3的质量;
②发生反应:8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O,结合方程式计算.
解答 解:(1)高锰酸钾稀溶液是一种常用的消毒剂,是由于高锰酸钾具有强氧化性,其消毒机理与双氧水、84消毒液相同,
故选:BD;
(2)滤液酸化后,K2MnO4转变为MnO2和KMnO4,则反应离子方程式为3MnO42-+4H+═MnO2↓+2MnO4-+2H2O,
故答案为:3MnO42-+4H+═MnO2↓+2MnO4-+2H2O;
(3)①n(Na2S2O3)=0.100mol•L-1×0.25L=0.025mol,
m(Na2S2O3)=0.025mol×158g/mol=3.950g,
故答案为:3.950;
②由反应方程式:8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O,可知n(KMnO4)=$\frac{8}{5}$n(S2O32-)=$\frac{8}{5}$×0.100 mol•L-1×20.00×10-3 L=3.20×10-3mol,
所以m(KMnO4)=3.20×10-3mol×158g/mol=0.5056g
KMnO4产品的纯度为:$\frac{0.5056g}{0.6000g}$×100%=84.27%;
答:该KMnO4产品的纯度为:84.27%.
点评 本题考查物质制备、物质含量测定、化学方程式计算、氧化还原反应等,难度不大,注意对基础知识的理解掌握.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定有SO2、NH3和NO | B. | 一定有NO和HCl | ||
| C. | 可能有Cl2和O2 | D. | 一定没有Cl2、NO2、NH3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
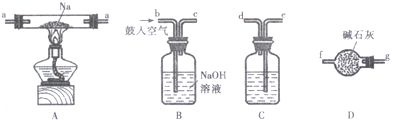
| 猜想 | 实验设计 | 现象与结论 |
| 剩余气体为H2(或O2). | 将b中剩余气体通过灼热的氧化铜 (或将b中剩余气体通过灼热的铜网). | 若看到黑色固体变红(或红色固体变黑), 证明此猜想正确,反之则不正确. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
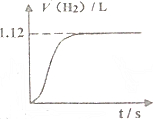 常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)
常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙和磷都是人体内含量丰富的矿物元素,属于常量元素 | |
| B. | 白色污染是指聚乙烯、聚氯乙烯等各种废塑料制品造成的污染 | |
| C. | 具有强吸附性的活性炭能吸附某些溶于水中的杂质,并能对水进行消毒 | |
| D. | 青霉素等抗生素对某些微生物有抑制或杀灭作用,但对人体细胞的毒性很低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com