
【题目】用![]() 、
、![]() 可以制备含有
可以制备含有![]() 的
的![]() 悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米![]() 。
。
(1)基态![]() 的核外电子排布式为__________。
的核外电子排布式为__________。
(2)与![]() 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。
(3)![]() 与
与![]() 反应能生成
反应能生成![]() ,
,![]() 中的配位原子为________(填元素符号)。
中的配位原子为________(填元素符号)。
(4)乙醛(![]() )中碳原子的轨道杂化类型是_________;
)中碳原子的轨道杂化类型是_________;![]() 中含有
中含有![]() 键的数目为________
键的数目为________![]() 。
。
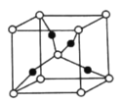
(5)一个![]() 晶胞(见图)中,
晶胞(见图)中,![]() 原子的数目为________。
原子的数目为________。
【答案】![]() 或
或![]() HF O
HF O ![]() 、
、![]() 6 4
6 4
【解析】
(1)根据核外电子排布规律书写;
(2)根据等电子体的概念解答;
(3)根据配位键的概念分析;
(4)根据轨道杂化理论分析;
(5)根据晶胞的结构分析计算。
(1)Cu为29号元素,基态Cu原子的核外电子排布式为![]() 或
或![]() ,Cu原子失去4s轨道的1个电子和3d轨道的1个电子后变成
,Cu原子失去4s轨道的1个电子和3d轨道的1个电子后变成![]() ,故基态
,故基态![]() 的核外电子排布式为
的核外电子排布式为![]() 或
或![]() ;
;
(2)原子总数相同、价电子总数相同的分子或离子互为等电子体,与![]() 互为等电子体的一种分子可以为HF;
互为等电子体的一种分子可以为HF;
(3)![]() 与
与![]() 反应能生成
反应能生成![]() ,
,![]() 中Cu2+提供空轨道,O原子提供孤电子对形成配位键,所以
中Cu2+提供空轨道,O原子提供孤电子对形成配位键,所以![]() 中的配位原子为O;
中的配位原子为O;
(4)乙醛(![]() )中甲基上的C原子形成4个σ键,无孤电子对,价层电子对数为4,故甲基上的C原子采取sp3杂化;醛基中的C原子形成3个σ键,无孤电子对,价层电子对数为3,故醛基上的C原子采取sp2杂化;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6mol σ键;
)中甲基上的C原子形成4个σ键,无孤电子对,价层电子对数为4,故甲基上的C原子采取sp3杂化;醛基中的C原子形成3个σ键,无孤电子对,价层电子对数为3,故醛基上的C原子采取sp2杂化;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6mol σ键;
(5)一个![]() 晶胞中,白球的个数为
晶胞中,白球的个数为![]() ,黑球的个数为4,又Cu2O中Cu和O的个数比为2:1,故白球为O原子,黑球为Cu原子,故一个
,黑球的个数为4,又Cu2O中Cu和O的个数比为2:1,故白球为O原子,黑球为Cu原子,故一个![]() 晶胞中,
晶胞中,![]() 原子的数目为4。
原子的数目为4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发非常重视。
(1)已知:①CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
②2NO2(g)![]() N2O4(g)ΔH2=-66.9kJmol1
N2O4(g)ΔH2=-66.9kJmol1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式_____________。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
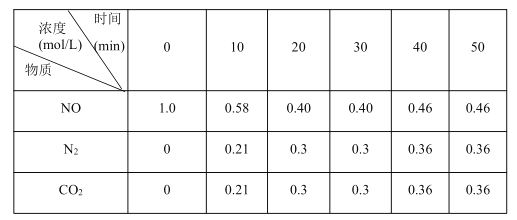
①根据表中数据分析,t1℃时,该反应在0~20min的平均反应速率v(NO)=_____________,该反应的平衡常数K=_____________。
②30min时,只改变某一条件,根据上表中的数据判断改变的条件可能是_____________(填字母代号)。
A.适当缩小容器的体积B.加入合适的催化剂
C.加入一定量的活性炭D.通入一定量的NO
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO的浓度之比为5∶3∶3,则达到新平衡时NO的转化率_____________(填“升高”或“降低”);ΔH_____________0(填“>”或“<”)。
(3)①已知在一定温度下,反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
②有一种可充电电池NaAl/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池负极电极反应式为Nae=Na+,则正极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用特殊电极材料制作的新型二次电池,放电时发生如下图所示的电极反应,下列说法正确的是
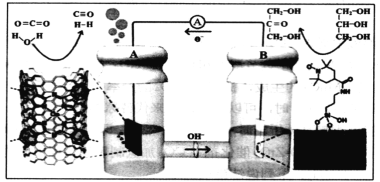
A.A为原电池的负极,失去电子,发生氧化反应
B.B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-=CH2OHCOCH2OH+2H+
C.若通过交换膜的离子是HCO![]() ,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO
,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO![]() =CH2OHCOCH2OH+2H2O+2CO2
=CH2OHCOCH2OH+2H2O+2CO2
D.若A处产生的CO和H2的物质的量之比为1:3,则B处消耗丙三醇的物质的量为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增加,X原子的半径小于Y原子,Y是地壳中含量最高的元素,Z原子的最外层只有1个电子,Y、W同主族。下列说法正确的是( )
A.原子半径:![]() B.Y与Z形成的化合物中只含离子键
B.Y与Z形成的化合物中只含离子键
C.W元素形成的最高价氧化物的水化物是强酸D.X与Z形成的化合物中X为![]() 价
价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为
A.CH3-O-CH2-CH3B.![]()
C.CH3CH2CH2OHD.C3H7OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图:
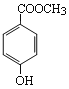
① 下列对尼泊金酯的判断正确的是______________。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.能与浓溴水反应产生白色沉淀。
② 尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是_________________________。
(2)C8H8O3的另一种同分异构体甲如图:
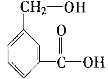
①请写出甲中所含官能团的名称________,________。
②甲在一定条件下跟Na反应的化学方程式是:__________。
③甲跟NaHCO3溶液反应的化学方程式是:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,![]() 的最高正价与最低负价的代数和为2,下列说法正确的是( )
的最高正价与最低负价的代数和为2,下列说法正确的是( )
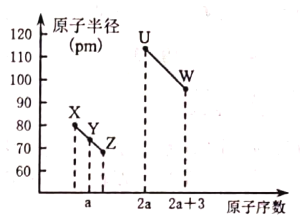
A.![]() 的最高价氧化物一定是酸性氧化物
的最高价氧化物一定是酸性氧化物
B.![]() 的单质是制造光导纤维的主要物质
的单质是制造光导纤维的主要物质
C.由![]() 和氢元素三种元素形成的化合物一定是共价化合物
和氢元素三种元素形成的化合物一定是共价化合物
D.X、U、W三种元素的氧化物对应的水化物酸性最强的是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为放热反应
B.达平衡时,容器Ⅱ中CH3OCH3的浓度大于0.16 mol/L
C.达平衡时,容器Ⅲ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
D.若起始时向容器Ⅰ中充入CH3OH(g)0.30 mol、CH3OCH3(g)1.50 mol和H2O(g)0.30 mol,则反应将向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com