
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()
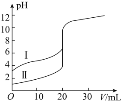
A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
科目:高中化学 来源: 题型:
【题目】工业上硫酸中的一步重要反应是SO2在400~500。C下的催化氧化2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是
A.通过调试反应条件,可以提高该反应的进行程度
B.使用催化剂的目的是加快反应速率,提高生产效率
C.达到平衡时,SO2和SO3的速率相等
D.提高反应温度,可以实现SO2的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为![]() 和
和![]() 反应生成
反应生成![]() 过程中的能量变化,下列说法中正确的是
过程中的能量变化,下列说法中正确的是
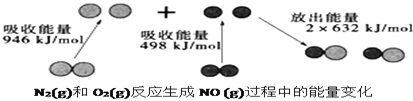
A.![]() 和
和![]() 完全反应放出的能量为180kJ
完全反应放出的能量为180kJ
B.通常情况下,![]() 和
和![]() 混合能直接生成NO
混合能直接生成NO
C.![]() 和
和![]() 具有的总能量小于
具有的总能量小于![]() 具有的总能量
具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A. 1mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B. 反应中还原产物分子数与氧化产物分子总数之比为1:3
C. 产生6.4g O2反应转移的电子总数为0.8NA
D. 0.5mol NH4ClO4分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
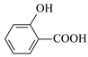
【题目】下列物质的性质比较,结论错误的是
A.硬度:金刚石>碳化硅>晶体硅
B.离子半径:S2->Cl->Na+>O2-
C.熔点:NaF>NaCl>NaBr>NaI
D.沸点:![]() >
>
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
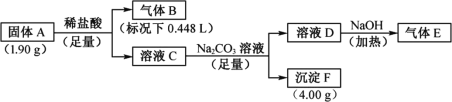
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件下可生成乌洛托品(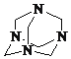 学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:
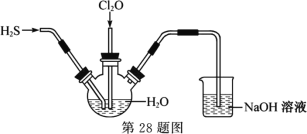
请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________。
(2) 若通入水中的Cl2O已过量,设计实验方案检验________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
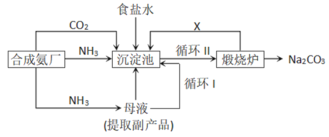
(1)实验室制取氨气的反应方程式为______
(2)上述生产纯碱过程副产品是______。
(3)沉淀池中发生的化学反应方程式是______。
(4)写出上述流程中X物质的电子式______。
(5)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(选填循环Ⅰ或循环Ⅱ)的循环。从沉淀池中取出沉淀的操作是_________。
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理:
B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大。)请回答下列问题:
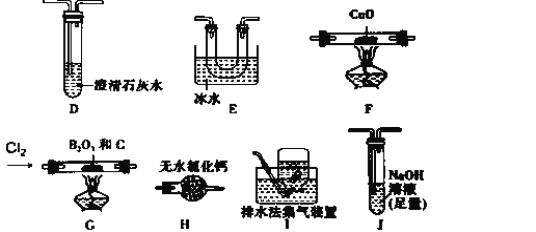
实验Ⅰ:制备BCl3并验证产物CO
(1)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式_______。
(2)该实验装置中合理的连接顺序为G→___→___→__→__→F→D→I;其中装置E的作用是____。
(3)能证明反应中有CO生成的现象是____。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④中达到滴定终点的现象为_____。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质,转化关系如图所示。下列说法正确的是( )

A.CO、SO2、SO3均是酸性氧化物
B.除去与水的反应,图示转化反应均为氧化还原反应
C.工业上利用Cl2和石灰乳反应来制取漂白粉
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com